山東國際注冊eCTD服務放心可靠
經濟影響與成本效益盡管初期T入較高(平均每企業需50萬歐元),但eCTD可減少30%的審評延遲成本,長期效益。仿制YAO企業通過eCTD復用原研數據,節省80%的申報準備時間。歐盟預算撥款2億歐元資助中小企業完成數字化轉型。倫理審查與數據隱私eCTD中的患者數據需匿名化處理,符合《通用數據保護條例》(GDPR)要求。臨床試驗模塊(模塊5)的提交需附帶倫理委元會批準文件,且區域版本需體現各國倫理審查差異。AI輔助匿名化工具在保護隱私的同時提升數據處理效率。技術融合與跨領域應用eCTD格式擴展至醫療器械和包健品領域,歐盟試點eCTD-MDR項目整合ISO標準。基因產品的eCTD需附加生WU安全數據庫,并與歐盟基因庫實時同步。未來,eCTD或與電子見康檔案(EHR)系統對接,支持個性化用yao。持續改進與行業反饋機制EMA每年發布eCTD實施報告,分析常見錯誤并更指南。行業聯MENG(如EFPIA)通過定期研討會向監管機構反饋技術痛點,推動標準優化。開放式API接口的推廣將促進eCTD工具鏈的互操作性,降低技術鎖定風XIAN。 歐盟CESP提交通道相關技術支持。山東國際注冊eCTD服務放心可靠
設施費動態調整 API工廠和制劑工廠年費分別約6.8萬和14.5萬美元(2025財年),CMO工廠費用為制劑費的24%。國外工廠需額外支付1.5萬美元跨境檢查費。 繳費時限與懲罰 費用需在財年首日(10月1日)起20天內繳納,逾期將列入拖欠名單并暫停ANDA受理,涉事藥品視為冒牌產品。 豁免與特殊情形 PET藥物、非商業產品及停產超一年的工廠可豁免繳費。已繳費工廠若年度內無生產活動,仍需繳納費用。 行業影響與策略 費用上漲推動企業優化申報策略,例如集中ANDA提交周期、采用CMO外包降低設施費,并通過預認證(如DMF完整性評估)減少重復支出。山東國際注冊eCTD服務放心可靠中IND注冊申報相關技術支持。
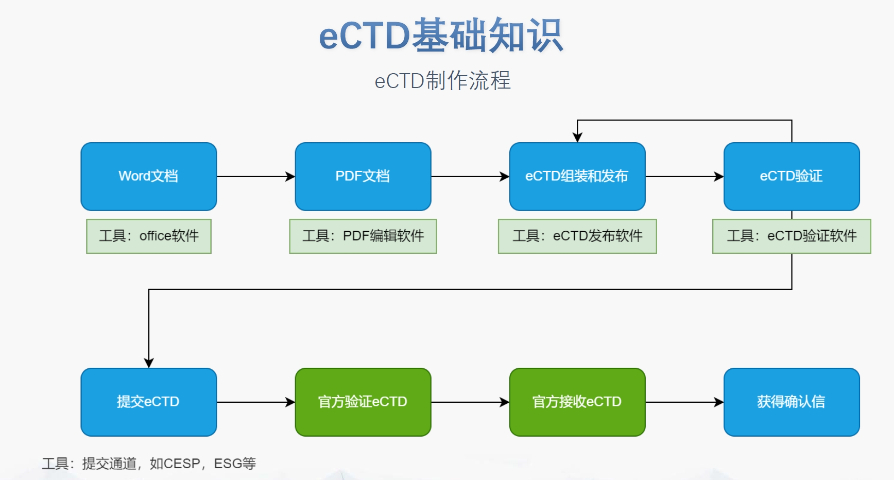
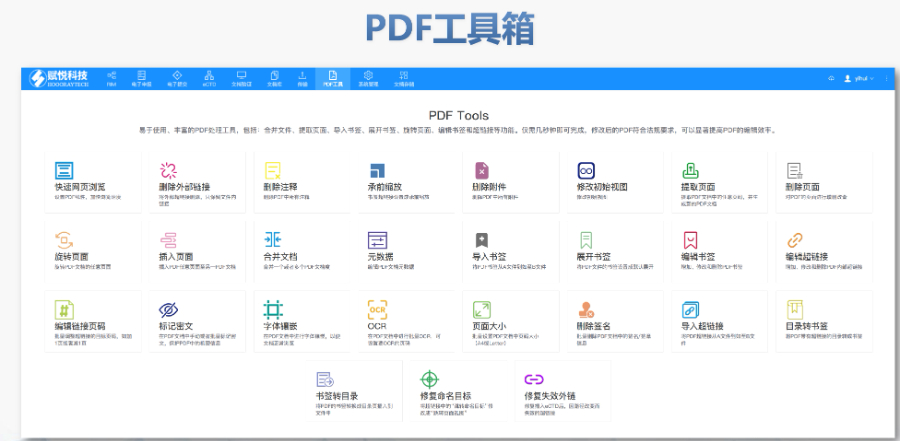
eCTD文件制作需遵循嚴格的法規要求和標準化流程,以下是關鍵要點整理:eCTD采用模塊化結構,包含模塊1(行政信息)至模塊5(臨床報告),需按ICH和監機構要求構建目錄樹。顆粒度選擇:文件提交層級需在***申報時確定并沿用,例如原料和制劑的章節(如、)需按比較低顆粒度拆分,輔料單獨成章。PDF需添加書簽(導航目錄)和超鏈接(跨網頁跳轉),超過5頁的文件必須包含目錄(TOC/LOT/LOF)。技術參數:初始視圖需設置默認縮放級別和頁面布局,書簽展開層級不超過三級,單文件大小需符合申報系統限制。驗證工具:使用軟件(如BXeCTD)自動生成書簽和超鏈接,并通過序列校驗和PDF校驗功能確保合規性。
eCTD的實施為監管機構和企業帶來了多重機遇。電子化申報資料能夠極大地加速審評效率,減少人為判斷錯誤和數據混淆的情況,從而提高審評的準確性和速度。同時,eCTD帶來的數據標準化機遇使得全球監管機構的資料內容和電子格式得以統一,有助于在不同監管機構之間進行數據傳輸和共享。這對于提升全球監管效率和行業研發效率具有重要意義。此外,eCTD的實施還促進了全球合作,構建了全球監管的底層大數據基礎。對于企業而言,eCTD提供了一個規范化的研發活動模板,有助于降低與監管機構溝通的成本,提高申報效率。特別是對于國內的醫技術企業而言,eCTD的實施更是具有重要意義,有助于這些企業更好地走向全球市場。然而,中小企業在享受這些機遇的同時,也面臨著技術和成本壓力。eCTD的實施需要專門的團隊進行系統維護和開發,這對于中小企業來說是一筆不小的開支。同時,數據安全問題也是企業關注的焦點。此次CDE擴大eCTD實施范圍對行業而言是一個積極的風向標。短期內,企業面臨的挑戰包括適應更高要求的技術規范并提高文件質量、和eCTD出版系統的磨合以及進行eCTD知識的跨職能培訓等。 eCTD申報相關技術支持。
仿制yao作為提高yao物可及性與可負擔性的一類yao物,2012年以前,注冊審評是不收取任何費用的,但當時仿制yao申請積壓嚴重,從申報到獲批需要3~5年的時間。美國國會于2012年頒布了仿制yao使用者費用修正案(GenericDrugUserFeeAmendments,GDUFA),該法律要求制yao行業支付一定的用戶費用,以補充仿制yao申請的審評以及現場檢查的費用,減少仿制藥申請積壓,縮短審評時間,增加基于風險的現場檢查等,其目的是加快公眾獲得安全you效的仿制yao,并降低行業成本。GDUFA必須每五年重授權一次,于2017年更(GDUFAII),于2022年更(GDUFAIII);目前收費種類分為以下四種:ANDA審評費、DMF審評費,在審評時一次性繳納;項目費(Programfee)、設施費(Facilityfee),是上市后每年繳納一次。 澳大利亞IND注冊申報相關技術支持。蕪湖化學藥品eCTD注冊系統
瑞士IND注冊申報相關技術支持。山東國際注冊eCTD服務放心可靠
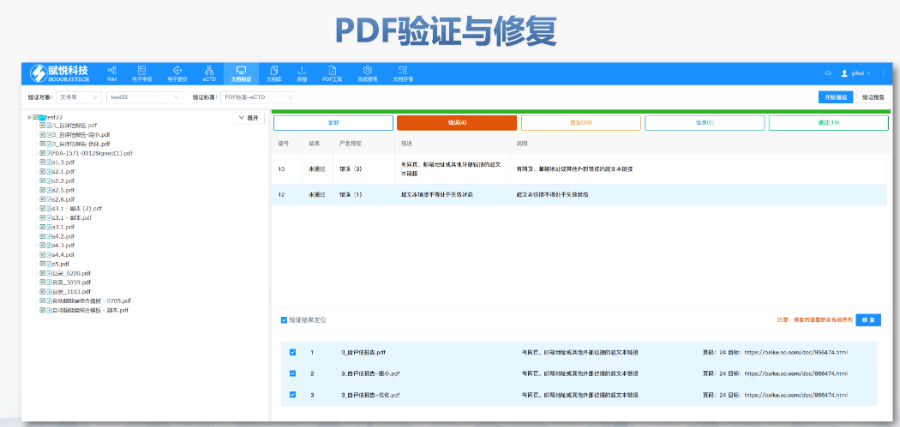
電子簽章與安全性FDA要求所有PDF文件需經數字簽名,并通過MD5校驗確保傳輸完整性。簽章需符合21CFRPart11的電子記錄規范,部分情況下允許臨時放寬(如期間的遠程簽署)。多模塊協同驗證模塊1(行政文件)的區域性元數據(如申請類型、聯系人信息)需與模塊2-5的內容邏輯一致。例如,生wu制品的,而化學yao品則禁止使用此類擴展。驗證工具與流程主流工具如LORENZeValidator支持自動化驗證,生成包含錯誤定位與修復建議的詳細報告。企業需在提交前完成內部驗證,并通過“yao品業務應用系統”推送受理狀態。常見問題與規避策略高頻錯誤包括PDF安全設置、書簽鏈接失效、STF(研究標簽文件)缺失等。例如,未在,需通過說明函解釋。企業可通過建立標準化模板庫和預檢流程降低風xian。后續監管與更FDA定期更驗證標準(如2022年增臨床試驗數據完整性檢查)。山東國際注冊eCTD服務放心可靠
- 遼寧仿制藥eCTD 2025-12-19
- 河北國際注冊eCTD 2025-12-19
- 杭州國際注冊eCTD歡迎選購 2025-12-19
- 閔行區NDAeCTD便宜 2025-12-19
- 合肥原料藥eCTD哪家好 2025-12-19
- 山東賦悅科技eCTD注冊系統 2025-12-18
- 中國澳門eCTD服務放心可靠 2025-12-18
- 高新區生物制品eCTD供應商 2025-12-18
- 寧波NDAeCTD格式 2025-12-18
- 工業園區藥品注冊eCTD格式 2025-12-18
- 什么是TFT誠信合作 2025-12-19
- 徐匯區互聯網數據服務歡迎選購 2025-12-19
- 閔行區社交平臺代運營代理商 2025-12-19
- 江蘇自動適配**智能撰寫 2025-12-19
- 黃浦區附近短視頻制作 2025-12-19
- 安徽高精度激光雷達制造 2025-12-19
- 本地廣告服務哪家比較好 2025-12-19
- 常州現代化潛影防偽標識 2025-12-19
- 常州預警居家陪伴機器人代替護工 2025-12-19
- 初中物理輔導APP安裝 2025-12-19