高新區生物制品eCTD供應商
eCTD的實施為監管機構和企業帶來了多重機遇。電子化申報資料能夠極大地加速審評效率,減少人為判斷錯誤和數據混淆的情況,從而提高審評的準確性和速度。同時,eCTD帶來的數據標準化機遇使得全球監管機構的資料內容和電子格式得以統一,有助于在不同監管機構之間進行數據傳輸和共享。這對于提升全球監管效率和行業研發效率具有重要意義。此外,eCTD的實施還促進了全球合作,構建了全球監管的底層大數據基礎。對于企業而言,eCTD提供了一個規范化的研發活動模板,有助于降低與監管機構溝通的成本,提高申報效率。特別是對于國內的醫技術企業而言,eCTD的實施更是具有重要意義,有助于這些企業更好地走向全球市場。然而,中小企業在享受這些機遇的同時,也面臨著技術和成本壓力。eCTD的實施需要專門的團隊進行系統維護和開發,這對于中小企業來說是一筆不小的開支。同時,數據安全問題也是企業關注的焦點。此次CDE擴大eCTD實施范圍對行業而言是一個積極的風向標。短期內,企業面臨的挑戰包括適應更高要求的技術規范并提高文件質量、和eCTD出版系統的磨合以及進行eCTD知識的跨職能培訓等。澳大利亞DMF注冊申報相關技術支持。高新區生物制品eCTD供應商
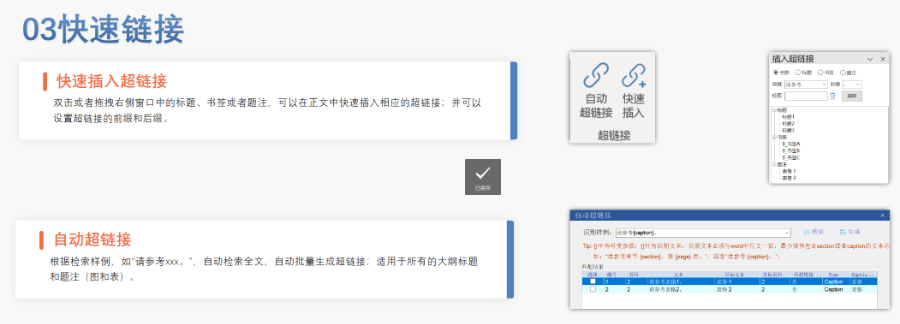
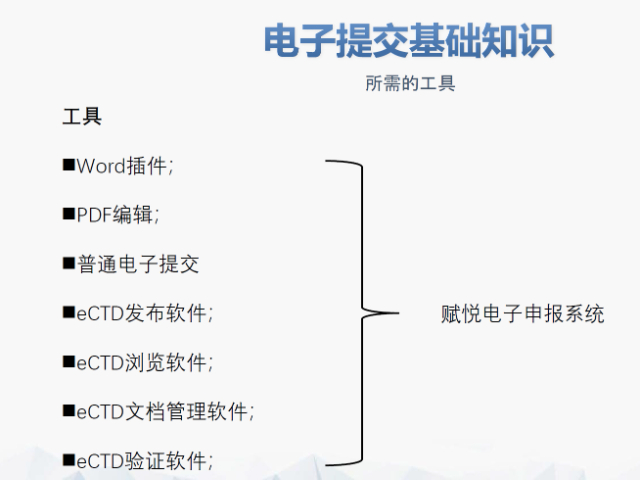
內容與格式檢查Word預處理:需檢查拼寫、縮略語、單位格式(如),設置多級列表自動編號(如),統一字體(宋體/TimesNewRoman)和段落格式。重復內容處理:相同劑型不同規格可共用模塊3,但需區分包裝系統(如、)。外文資料:中文在前、原文在后,參考文獻需中英文對照并建立跨網頁鏈接。使用符合ICH標準的eCTD編輯器自動生成XML骨架和MD5校驗值,拖拽PDF文件構建結構樹。序列管理:序列號從0000開始遞增,每次提交需更新序列,生命周期狀態(New/Replace/Delete)需在XML中明確標注。驗證與遞交:確保無驗證錯誤(如書簽缺失、超鏈接斷鏈),通過ESG等電子通道傳輸,光盤封面需包含申請號和序列號。全生命周期管理版本:通過軟件實現網頁簽入/簽出、審批流程,支持歷史版本追溯。變更管理:增補(Append)和替換(Replace)需關聯原始序列,刪除(Delete)需徹底移除無效文件。吳江區藥品注冊eCTD使用瑞士eCTD注冊咨詢相關技術支持。
電子簽章與傳輸安全文件需經AES-256加密后刻錄至不可擦寫光盤,并附MD5校驗碼。光盤損壞或bing毒污染將觸發重遞交流程,原載體按銷毀程序處理。審評與核查協同自2018年起,FDA要求提交兩套光盤分別用于審評和現場核查,2022年調整為“1套審評+1套核查+1套專項資料”模式,提升流程效率。guo際化兼容性增強美國eCTD系統支持與歐盟、日本等地區的XML互操作性,但區域差異(如模塊1的標簽要求)仍需人工適配。未來通道創FDA計劃引入API接口支持企業系統直連,并探索基于云存儲的實時提交與審評,減少物理媒介依賴。
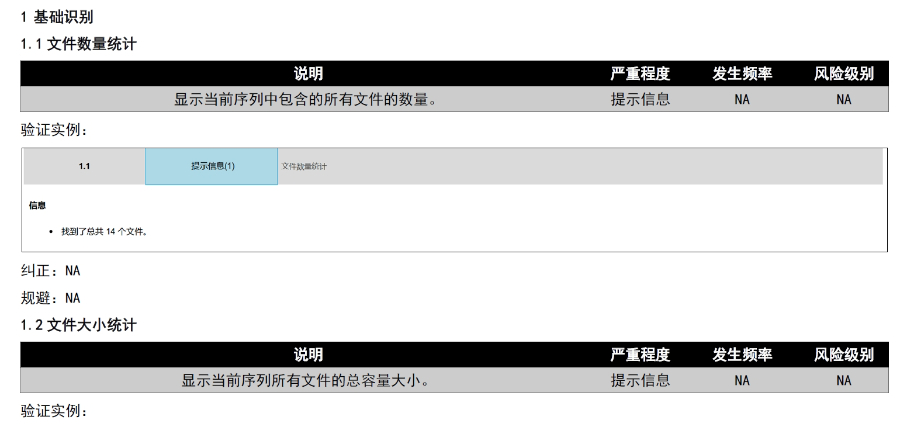
文件生命周期管理:eCTD支持文件替換(Replace)、刪除(Delete)等操作,而非增文件。例如,更臨床研究方案時需用Replace操作覆蓋舊版本。基線提交(BaselineSubmission)可用于補充歷史紙質資料,但需在封面函中聲明無內容變更。臨床數據與研究標簽文件(STF):模塊4和5中的研究數據需通過STF(StudyTaggingFiles)引用,確保數據與文檔關聯。FDA要求數據集(如SASXPORT格式)能置于模塊3-5,且單個文件超過4GB需拆分。2022年統計顯示,58%的ANDA因研究數據技術拒絕標準(TRC)錯誤被拒。電子簽名與表格要求:FDA表格(如356h、1571)需使用數字簽名,PDF文件禁止加密或設置編輯限制。電子簽名需符合21CFRPart11規范,確保身份驗證、不可否認性和數據完整性。外包服務與系統解決方案:賦悅科技累計提交超2000份eCTD申請,外包可降低40%人工錯誤率。歐盟DMF注冊申報相關技術支持。
GDUFAIII框架與費用分類2022年更的GDUFAIII將費用分為ANDA申請費、DMF認證費、項目費及設施費四類,實施周期至2027年。2025財年ANDA費用至約22萬美元,較2024年增幅達,反映審評成本上升。ANDA申請費規則費用需在提交時繳納,若申請被拒可退還75%。重提交視為申請,需再次繳費。關聯API的工廠數量影響總費用,例如某ANDA引用3個API且涉及6家工廠,需支付6倍DMF費用。DMF費用機制II類原料YAODMF需在引用前繳費,一次性支付約(2025財年)。未繳費DMF不得用于支持ANDA,否則觸發退審。項目費分級管理根據企業獲批ANDA數量分為大、中、小型三級,2025年大型企業年費約34萬美元。附屬公司ANDA數量合并計算,繳費責任可由母公司或任一附屬公司承擔。 eCTD申報軟件相關技術支持。浦東新區新藥eCTD性價比高
歐盟CESP提交通道相關技術支持。高新區生物制品eCTD供應商
法規文檔管理系統協同共享RDMS可以讓跨區域、跨部門協同真正成為1+1>2的工作。讓頻繁的文檔共享傳輸,版本管理,生命周期審批都變得輕松簡單安全合規通過詳細的審計追蹤、電子簽名、權限管理、網關控zhi、頁面控zhi等技術手段,構建安全合規的文檔管理系統,通過安全驗證與合規驗證統一文檔來源yao品注冊是企業經營成果的技術資料,由多個部門長時間匯集到法規部門。RDMS確保多部門文檔來源統一,即使人員流動也可以快su接續工作統一文檔結構根據不同申報類型,自動生成文檔結構,讓法規人員與跨部門同事掌握申報需要的資料需求,降低溝通成本,降低經驗需求,避免疏忽遺漏。高新區生物制品eCTD供應商
- 中國澳門eCTD服務放心可靠 2025-12-18
- 高新區生物制品eCTD供應商 2025-12-18
- 江蘇藥品注冊eCTD軟件 2025-12-18
- 山東國際注冊eCTD服務放心可靠 2025-12-18
- 楊浦區國產eCTD服務放心可靠 2025-12-18
- 安徽電子申報eCTD性價比高 2025-12-18
- 杭州電子申報eCTD服務價格 2025-12-18
- 浙江中國eCTD報價 2025-12-18
- 工業園區新藥eCTD格式 2025-12-18
- 合肥國產eCTD 2025-12-18
- 浙江窄邊框OLED透明屏采購價格 2025-12-18
- 攀枝花貿易精斗云云進銷存 2025-12-18
- 南京立體化電話交換系統規定 2025-12-18
- 自動化針紡織品銷售常見問題 2025-12-18
- 重慶MES系統報價 2025-12-18
- 黑龍江電影攝制服務開展 2025-12-18
- 智能調度性通信網絡系統設計售后服務 2025-12-18
- 山東企業跨網安全域文件交換怎么購買 2025-12-18
- 貴陽專業級智能營銷云平臺客戶生命周期管理工具 2025-12-18
- 天長數據驅動網站搭建標準 2025-12-18