靜安區仿制藥eCTD哪個品牌好
eCTD即是電子化的CTD注冊申報方式,相對于傳統的紙質遞交,eCTD電子遞交更便捷、更安全。對于申請者來說,一個產品如在多個市場遞交,M2-M5的資料可以共享,極大降低了成本并提高了效率;對審評者來說,eCTD資料的審閱、管理、傳輸以及歸檔十分便捷,eCTD格式同時也利于各個地區的yao監部門的審評意見交流。eCTD遞交自2003年開始實施以來,以其在創建、傳輸、復制、審閱、檢索、存檔以及文件生命周期管理等方面的優勢當之無愧地成為全球YAO品注冊申報的大勢所趨,除了傳統的美國、日本和歐盟等ICH成員國之外,加拿大、瑞士、沙特阿拉伯、南非、澳大利亞、新西蘭、泰國、新加坡、韓國等地區都已經部分采納或者正在逐步轉向eCTD遞交。賦悅科技,做為國內自主研發服務器版eCTDYAO品注冊申報軟件,讓法規注冊事務從系統上極大縮短申報周期,助力企業加快產品上市速度。迅速實施,上手簡單,項目管理,超鏈接管理,權限管理,審計追蹤;網頁登錄,異地辦公,多人協同,eCTD文件導入,PDF批量一鍵修復。同時提供短期租賃服務,在保證合規的前提下,為企業降本增效。 eCTD驗證實踐手冊相關技術支持。靜安區仿制藥eCTD哪個品牌好

eCTD文件制作需遵循嚴格的法規要求和標準化流程,以下是關鍵要點整理:eCTD采用模塊化結構,包含模塊1(行政信息)至模塊5(臨床報告),需按ICH和監機構要求構建目錄樹。顆粒度選擇:文件提交層級需在***申報時確定并沿用,例如原料和制劑的章節(如、)需按比較低顆粒度拆分,輔料單獨成章。PDF需添加書簽(導航目錄)和超鏈接(跨網頁跳轉),超過5頁的文件必須包含目錄(TOC/LOT/LOF)。技術參數:初始視圖需設置默認縮放級別和頁面布局,書簽展開層級不超過三級,單文件大小需符合申報系統限制。驗證工具:使用軟件(如BXeCTD)自動生成書簽和超鏈接,并通過序列校驗和PDF校驗功能確保合規性。浦東新區仿制藥eCTD文件如何制作加拿大eCTD申報軟件相關技術支持。

從紙質到電子的歷史過渡 2017年前,美國允許紙質與eCTD并行提交,但此后逐步淘汰紙質通道,保留緊急情況下的例外審批。2020年電子化后,所有IND、NDA、ANDA和DMF強制采用eCTD格式。 系統平臺升級 FDA通過“yao品業務應用系統”和“yao品eCTD注冊系統”實現電子資料接收、受理與審評的全流程數字化。2022年系統增自動推送受理文書和短信提醒功能,減少人工干預。 電子文檔結構優化 美國eCTD采用分層文件夾結構,例如化學yao品的模塊1-5分別對應行政文件、總結報告、質量數據等。2020年后增“臨床試驗數據庫”裝盒要求,強化數據可追溯性。
DMF維護與合規年度更即使無變更,每年需提交聲明;重大工藝/設施變更需及時通知客戶并更文件。現場檢查原料YAO企業需通過FDA現場檢查,驗證是否符合ICHQ7GMP標準,并與DMF內容一致。轉讓與關閉轉讓:需書面通知FDA并提供持有者信息。關閉:未提交年度報告或持有人主動申請,需說明原因并通知所有授權方。關鍵注意事項數據質量:所有資料需準確、完整,減少審核延遲FENG險。合規性:遵循FDA指南(如21CFRPart207)及USP標準(如培養基物料來源級別)。溝通機制:建議通過專YE機構(如FUYUE)協助,定期提交周報并制定計劃表以提高效率。常見問題解答生WU制品分類:培養基、外泌體等均屬Ⅱ類DMF。質量標準:參考USP及同行標準,需提供分析方法驗證及雜質對比研究。周期估算:資料準備約5-50個工作日,總周期受缺陷回復影響。 eCTD注冊外包相關技術支持。
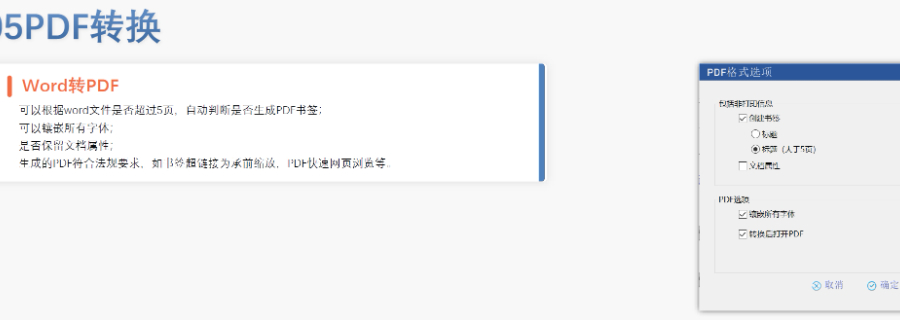
生命周期管理與變更遞交eCTD支持全生命周期管理,申請人需通過序列更(Sequence)反映yao品變更信息。例如CEP的更需提交“變更說明表”,對比已批準和擬修改內容,并附修訂版技術文檔。重大變更(如生產工藝調整)可能觸發GMP現場檢查,EDQM將根據feng險評估決定是否啟動核查。電子簽名與法律效力歐盟接受符合《電子簽名法》的數字簽名,手寫簽名的掃描件需嵌入PDF并加密保護。模塊1的申請表和承諾書必須包含you效簽名,且XML文件需通過MD5校驗確保完整性。若使用第三方簽署工具,需提前向監管機構報備并獲取技術認可。中小企業支持與資源獲取EMA和EDQM為中小企業提供eCTD實施指南、驗證工具及培訓研討會。例如,EDQM官網發布CEP遞交模板和案例庫,EMA則定期更Q&A文檔以解答常見問題。此外,歐盟設立專項基金,資助中小企業完成eCTD轉換和系統部署。 澳大利亞ANDA注冊申報相關技術支持。無錫中國eCTD便宜
瑞士eCTD注冊外包相關技術支持。靜安區仿制藥eCTD哪個品牌好
美國eCTD的強制實施時間與范圍:美國自2017年5月5日起要求申請(NDA)、仿制yao申請(ANDA)和生物制品許可申請(BLA)必須通過eCTD格式提交,2018年5月5日進一步擴展至臨床試驗申請(IND)和yao品主文件(DMF)。FDA通過《聯邦食品、yao品和化妝品法案》第745A條明確電子提交的強制性,豁免非商業化IND和部分DMF類型(如Ⅲ類)。2023年數據顯示,FDA接收的eCTD申請占比已達92%,標志著電子化審評體系的成熟。企業若未按規范提交(如缺少文件或重復序列號),將直接被拒收。靜安區仿制藥eCTD哪個品牌好
- 遼寧仿制藥eCTD 2025-12-19
- 浦東新區仿制藥eCTD服務電話 2025-12-19
- 無錫賦悅科技eCTD報價 2025-12-19
- 上海國產eCTD服務電話 2025-12-19
- 河北國際注冊eCTD 2025-12-19
- 吳江區賦悅科技eCTD使用 2025-12-19
- 靜安區仿制藥eCTD哪個品牌好 2025-12-19
- 杭州國際注冊eCTD歡迎選購 2025-12-19
- 太倉中國eCTD常用解決方案 2025-12-19
- 閔行區NDAeCTD便宜 2025-12-19
- TO封裝技術廠家 2025-12-19
- 山西一維無線掃描槍 2025-12-19
- 鹽田區新型智能手表 2025-12-19
- 湖南移動電源3C認證哪家便宜 2025-12-19
- 湛江小型民宿管理系統哪種好 2025-12-19
- 智能終端 2025-12-19
- 臨沂一對多掃描槍推薦 2025-12-19
- 紹興晶圓切割代工廠 2025-12-19
- 遼寧仿制藥eCTD 2025-12-19
- 什么是打印紙哪家便宜 2025-12-19