山西qPCR法宿主細胞殘留DNA檢測
來源:
發布時間:2025-09-22
SHENTEK® Hi5&AcNPV 殘留 DNA 檢測試劑盒(多重 PCR-熒光探針法)用于定量檢測昆蟲細胞(High Five)桿狀病毒表達系統來源的基因工程疫苗中殘留的 Hi5 細胞 DNA和桿狀病毒(AcNPV)DNA 的試劑盒。本試劑盒利用熒光探針原理,采用多重 qPCR 的方法定量檢測樣品中 Hi5 和 AcNPV殘留 DNA。檢測快速,專一性強,性能穩定可靠,檢測限可以達到 50 copies/反應。試劑盒配套有 Hi5&AcNPV 定量參考品。本試劑盒與 SHENTEK®宿主細胞殘留 DNA 樣本前處理試劑盒配套使用,可準確定量樣品中殘留的 Hi5&AcNPV 微量 DNA。
rHCDpurify? 前處理系統,助力宿主細胞殘留 DNA 檢測樣本處理。山西qPCR法宿主細胞殘留DNA檢測
SHENTEK®釀酒酵母殘留DNA檢測試劑盒(PCR-熒光探針法),可對各類生物制品及藥品的中間品、半成品與成品中釀酒酵母宿主細胞DNA進行定量檢測。該試劑盒基于熒光探針法原理,實現對樣品中釀酒酵母殘留DNA的定量分析,具備檢測快速、專一性強、性能穩定可靠的特點,檢測限可達到fg級別,且內配套釀酒酵母DNA定量參考品。本試劑盒與SHENTEK®宿主細胞殘留DNA樣本前處理試劑盒搭配使用,可實現對樣品中殘留微量釀酒酵母細胞DNA的準確定量。整個分析系統通過優化前處理與檢測步驟的兼容性,能有效提升對釀酒酵母細胞微量DNA殘留的回收率及定量準確度。
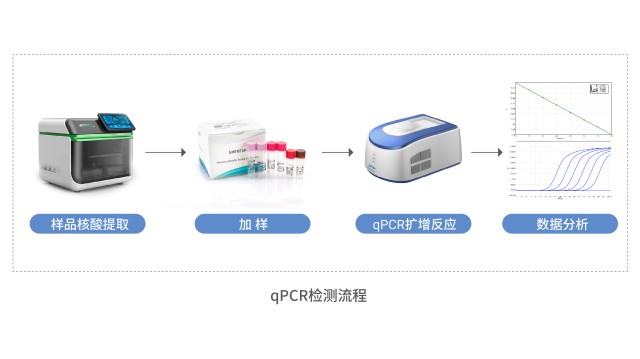
qPCR法宿主細胞殘留DNA檢測宿主細胞殘留DNA檢測通過樣品前處理和 qPCR 檢測方法,實現高通量、高靈敏度、高效率和高準確性。
生物制品宿主細胞殘留 DNA 檢測是生物制藥領域的關鍵質量控制環節,主要目的是定量監測疫苗、單抗、基因治療產品等生物制品中宿主細胞來源的 DNA 殘留量,以此評估潛在安全風險并確保符合法規要求。其關鍵價值在于:殘留 DNA 可能攜帶致病基因、病毒序列及致瘤性片段,若未有效管控,可能通過基因整合或免疫原性反應對使用者構成風險。依托定量 PCR、雜交法等高精度方法開展的宿主細胞殘留 DNA 檢測,并非單純的合規流程,更是阻斷藥品轉化性風險的科學屏障,是保障每一劑生物藥安全惠及患者的必要責任與承諾。
MDCK 細胞作為宿主工程用細胞,其宿主細胞DNA殘留會給機體帶來安全風險。雖然 MDCK 細胞基質流感疫苗生產中,已采用超濾、核酸酶處理、層析、β- 丙內酯滅活等工藝去除殘留 DNA,但疫苗產品里仍可能殘留宿主細胞DNA 及其片段。所以,為把控疫苗質量,需對疫苗中的 MDCK 宿主細胞殘留 DNA 及其片段開展檢測與分析。湖州申科生物推出 MDCK 殘留 DNA 檢測試劑盒與 MDCK DNA 殘留片段分析檢測試劑盒,幫助相關疫苗企業對 MDCK 流感疫苗的 HCD 實施全過程監控。宿主細胞殘留DNA檢測的擴增曲線,需呈正常 “S” 型保障有效。
若宿主細胞殘留 DNA 檢測擴增效率未達標,建議分階排查。第一步查數據:調取標曲擴增圖,核對是否呈標準 S 型、整體熒光值是否過低、復孔信號是否重疊、通道選擇是否恰當、是否存在離群孔及程序參數是否準確。第二步查耗材設備:驗證 EP 管是否無菌低吸附,移液器與 PCR 儀是否在校驗期內,儀器與耗材規格是否匹配。第三步查人員試劑:對比是否只有個別操作者結果異常,確認試劑儲存溫度及凍融次數是否合規,并定位異常是否自某時點集中爆發。完成三輪篩查后,細審操作:梯度稀釋是否充分渦旋且時長足夠,吸液前是否預潤吸頭,移液速度是否一致,MIX 是否適度顛倒或短時渦旋,上機前是否再次離心混勻,分析時基線區間與閾值設定是否得當,ROX 修正步驟是否執行到位。宿主細胞殘留DNA檢測數據是產品放行的重要依據。廣東MDCK宿主細胞殘留DNA檢測生產企業
生物制品宿主細胞殘留 DNA 可能存在污染風險,將對產品使用者帶來??潛在安全性影響。山西qPCR法宿主細胞殘留DNA檢測
重組蛋白、抗體、疫苗、細胞與基因產品等生物制品大多來自生物工程細胞 ( 細菌、酵母、動物或人源細胞 ) 的復雜表達 / 生產系統,不同宿主的 rHCD 和 rHCR 不同,且存在不同片段長度和組成的復雜陣列,其風險須根據具體情況評估。各國藥品監督管理機構對終產品中宿主細胞殘留 DNA 的含量有著嚴格的限度控制,大多為不超過 10ng/ 劑或更低。湖州申科生物自主開發一系列宿主細胞殘留 DNA熒光探針 qPCR 定量檢測試劑盒,以及特定細胞系定制化試劑盒的開發、生產和測試,可滿足不同宿主檢測需求。
山西qPCR法宿主細胞殘留DNA檢測
下一篇:
陜西宿主細胞殘留DNA檢測常見問題
相關新聞
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- PG13宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-12-19
- CHO宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-12-19
- 北京高效內毒素檢測商業化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
- 江蘇生物制品內毒素檢測重組級聯試劑(rCR) 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測 2025-12-19
- 浙江定制化宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證 2025-12-19
- SV40LTA&E1A宿主細胞殘留DNA檢測 2025-12-19
- 江蘇細菌內毒素檢測結果判定 2025-12-19
推薦新聞
- 上海黍峰生物多功能群體光合儀多少錢 2025-12-20
- 西工附近有臨終關懷服務的醫療型養老中心 2025-12-20
- 浙江常用哺光儀 2025-12-20
- 山西聚甲醛產品 2025-12-20
- 醫療器械結扎夾掛網 2025-12-20
- 山西國內助膝器運動人群 2025-12-20
- 綜合醫院一體化臨床系統優點 2025-12-20
- 洛龍口碑好的老年護理機構 2025-12-20
- 江蘇科研用植物表型平臺 2025-12-20
- 浙江一體化智能醫廢管理收集車生產廠家 2025-12-20