廣東免疫細胞產品支原體檢測技術服務
來源:
發布時間:2025-11-14
湖州申科的支原體檢測方案已在多個領域積累了豐富的客戶申報案例,覆蓋細胞療法、抗體藥物、疫苗、CRO/CDMO 等細分賽道。在細胞療法領域,方案成功應用于已上市藥物的方法變更,替換進口試劑盒并通過中檢院復核,驗證結果獲得 CDE 認可用于產品放行檢測在抗體藥物領域,支持多家企業完成 BLA 申報;在疫苗與 CRO/CDMO 領域,為諸多頭部企業提供 IND 申報支持。方案的應用場景涵蓋從 IND 到 BLA/NDA 的全申報周期,適配自動化提取 + 檢測試劑盒 + 菌株 + qPCR 儀、外源因子一體機等多種配置,滿足不同企業的個性化檢測需求,獲得市場認可。
生物制品企業需建立支原體檢測質量體系,滿足 GMP 與法規要求。廣東免疫細胞產品支原體檢測技術服務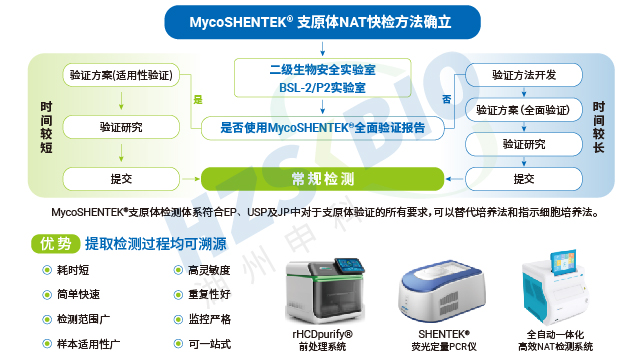
可比性驗證是支原體檢測 NAT 方法替代傳統檢測方法的關鍵依據,法規明確要求需將 NAT 法與藥典規定的傳統方法進行檢測限(LOD)對比。若以 NAT 法替代培養法,需證實其檢測限≤10CFU/mL;替代指示細胞培養法時,每種被測支原體的檢測限需≤100CFU/mL。對比實驗需采用相同樣本同步開展 NAT 檢測與傳統方法檢測,通過 CFU 可比性分析,確保兩種方法的檢測結果具有一致性。這一要求既保障了新方法的檢測效能不低于傳統標準,又為生物制品企業切換檢測方法提供了合規依據,兼顧了效率提升與質量安全。
天津復雜基質支原體檢測技術服務一體化支原體檢測卡盒集成全流程,相當于迷你 qPCR 實驗室,普通環境即可使用。
取樣量的科學設計直接影響支原體檢測的代表性與靈敏度,需結合樣品總體積、基質特性綜合考量。法規建議:產品總體積大于1000mL的按無菌檢查法取樣,10-1000mL 取總體積的 1%,1-10mL 取 100μL,小于1mL的需采用替代取樣方案。實際檢測中,取樣體積越大,靈敏度越高,但需平衡洗脫液消耗與重復檢測需求。此外,支原體兼具胞內胞外生存特性,只檢測上清會導致漏檢,需采用細胞裂解等處理方式,確保覆蓋全部污染靶點,提升檢測結果的真實性。
全球主流藥典均認可 NAT 法作為支原體檢測的替代方法,但明確要求需經過充分驗證并證明與傳統方法的可比性。歐洲藥典(EP)2.6.7 規定 NAT 法可作為替代方法,需開展供試品抑制性驗證;美國藥典(USP)63&77 要求替代方法需與培養法、指示細胞培養法均具備可比性,且 USP<77> 專門針對支原體 NAT 法的驗證與檢測制定了規范;日本藥典(JP)G3-14-170 允許經適當驗證后的 NAT 法替代傳統方法;中國藥典 3301 及相關指導原則明確,CAR-T、干細胞等新型產品可采用 NAT 法,但需充分驗證其最低檢出限不低于藥典方法,早期需與藥典方法并行使用。此外,各國法規均強調,NAT 法的選擇、開發與應用需基于科學依據,充分考慮培養基、生產工藝、潛在污染菌株等因素。
申科依托 CNAS 認證實驗室提供支原體檢測服務,可配合監管機構現場審計,確保合規性。
建立可靠的支原體檢測 NAT 平臺需整合實驗室建設、人員培訓、污染控制、方法驗證四大關鍵要素,同時依托完善的一站式方案。實驗室建設需實現工作區域嚴格劃分與完整配套設備部署,為檢測提供硬件支撐。人員需接受規范的現場實驗操作培訓,熟練掌握檢測流程與問題排查技巧。污染控制需貫穿全流程,遵循分區操作、規范消毒、廢棄物處理等要求,從源頭規避污染風險。方法驗證需覆蓋檢測限、專屬性、耐用性等指標,確保方法合規可靠。湖州申科提供的一站式方案包含硬件設備、試劑盒產品與使用方案,同時提供污染防控規范指導、性能驗證方案與報告,助力生物制品 QC 部門快速搭建高效、合規的支原體檢測平臺。
支原體檢測試劑盒需覆蓋常見污染菌株,避免因菌株遺漏導致漏檢。廣東細胞療法產品支原體檢測NAT法支原體檢測結果判定需結合 FAM 與 VIC 信號,警惕基質抑制導致的誤判。廣東免疫細胞產品支原體檢測技術服務
湖州申科生物構建了完整的支原體檢測解決方案,包含支原體 DNA 提取純化試劑盒與檢測試劑盒兩大產品。提取純化試劑盒采用磁珠法技術,具有回收率高、樣品兼容性強的優勢,配合湖州申科 rHCDpurify®前處理系統可實現自動化提取操作,大幅提升檢測效率并減少人為誤差。檢測試劑盒采用 PCR - 熒光探針法,覆蓋近200種支原體 DNA 序列,檢測專一性強,且對不同品牌 PCR 儀器具有良好的適用性,性能穩定可靠。產品規格明確,提取試劑盒可處理 50 個樣品,檢測試劑盒可完成 50 次反應,整套體系從樣品前處理到定性檢測形成閉環,滿足生物制品生產各環節的支原體篩查需求。
廣東免疫細胞產品支原體檢測技術服務
上一篇
廣東免疫細胞產品支原體檢測培養法
下一篇:
福建疫苗產品支原體檢測方法學驗證
相關新聞
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- PG13宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-12-19
- CHO宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-12-19
- 北京高效內毒素檢測商業化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
- 江蘇生物制品內毒素檢測重組級聯試劑(rCR) 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測 2025-12-19
- 浙江定制化宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證 2025-12-19
- SV40LTA&E1A宿主細胞殘留DNA檢測 2025-12-19
- 江蘇細菌內毒素檢測結果判定 2025-12-19
推薦新聞
- 海南哪里有醫用高分子夾板技術指導 2025-12-20
- 浦東新區聚甲醛誠信合作 2025-12-20
- 昆山瑞克式助聽器上門驗配 2025-12-20
- 成都輕便上臂假肢 2025-12-20
- 奉賢區運用實驗儀器專賣店 2025-12-20
- 崇明區作用實驗儀器市價 2025-12-20
- 稱量分離細胞培養皿 2025-12-20
- DNA植絨拭子批發廠 2025-12-20
- 1-溴-2-芐氧基乙烷報價 2025-12-20
- 上海隱形助聽器定制 2025-12-20