吉林疫苗產品支原體檢測使用性驗證
來源:
發布時間:2025-11-14
湖州申科支原體檢測解決方案優勢突出,一是產品驗證專業:嚴格確認菌株 GC 比,可溯源至 ATCC/CVCC,專屬性驗證涵蓋多種梭菌、乳桿菌、鏈球菌,完全符合 EP 要求,而部分競品未明確菌株驗證標準或缺乏近緣菌交叉污染測試;二是菌株資源豐富:提供可溯源、可商用的驗證菌株,嚴格控制 GC 比,聯合合規機構共同標定;三是一站式解決方案:涵蓋 “產品 + 菌株 + 技術服務” 全鏈條,擁有上市藥物方法變更驗證服務案例,可提供全申報周期支持;四是申報案例豐富:積累了 BLA、IND 階段的多個成功案例,支持客戶完成國產替代與方法變更,競品申報案例相對有限,且部分企業規模較小,難以接受供應商審計,服務穩定性不足。
歐洲藥典2.6.7 要求測定支原體 GC/CFU 時,需同時考量上清與細胞組分,避免數據偏差。吉林疫苗產品支原體檢測使用性驗證
湖州申科推出的 MycoSHENTEK® 支原體驗證菌株,符合全球藥典要求,目前已提供口腔支原體、肺炎支原體、豬鼻支原體三種菌株,后續將逐步擴充其他驗證用菌株。該系列菌株溯源至全球保藏機構并獲得正式授權,經培養法測定 CFU(菌落形成單位)與 dPCR 法測定 GC(基因組拷貝數),實現準確定量標定,濃度涵蓋 10CFU 和 100CFU 兩種規格,每盒含 3 管,完全滿足支原體檢測方法驗證需求。菌株經滅活處理,無風險,使用時只需加入相應體積樣品基質即可開展驗證,操作便捷,同時通過雙重定量檢測確保質量可控,為 NAT 方法驗證提供可靠的標準物質支撐。
吉林疫苗產品支原體檢測使用性驗證支原體標準菌株在生物制藥與生物檢測行業中承擔著關鍵角色,其重要性將隨著生物制品的發展而愈發凸顯。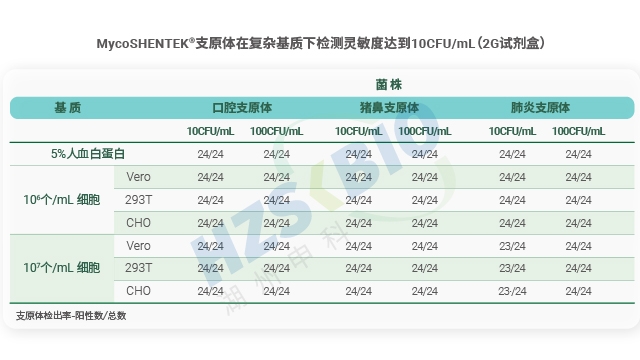
AdvSHENTEK外源因子全自動核酸檢測分析系統以 “迷你 qPCR 實驗室” 的創新形態,突破了傳統支原體檢測的場地限制。整套系統尺寸為 380mm×305mm×343mm,重量只有 14kg,體積小巧、易于部署,無需專門的 PCR 實驗室,只需一間普通實驗室即可滿足檢測需求,大幅降低了企業的場地投入成本。這與傳統 NAT 法需嚴格劃分試劑準備區、樣本制備區、擴增區等多個功能區域的要求形成鮮明對比,尤其適合場地資源緊張的中小企業。同時,系統一體化設計減少了耗材搭配與損耗,自動化流程降低了人為操作失誤導致的重復檢測成本,從場地、人力、耗材多維度為企業實現降本增效,讓支原體檢測更具經濟性。
湖州申科構建了具有完備資質的支原體技術服務平臺,為企業提供多元化支持。平臺擁有 BSL-2/P2 微生物實驗室備案資質,遵循 GMP-like 質量體系,具備支原體培養法、指示細胞法與 qPCR 法的檢測及驗證能力,配備符合藥典要求的支原體標準菌株庫與高靈敏度培養基(含液體、固體、半流體)。企業已通過 ISO13485:2016 質量管理體系認證(證書號 MD 709873),檢測中心獲得 CNAS 認證(注冊號 CNAS L21942),符合 ISO/IEC 17025:2017 標準,具備國際互認資質。平臺可提供多元化技術服務,包括支原體 qPCR 法檢測能力建立、實驗員能力考核、質量體系與流程搭建、實驗室設計方案優化,以及樣品檢測(三種方法)、樣品適用性驗證、方法學驗證、傳統法與 qPCR 法比對、特殊菌株定制生產等,申報階段可配合客戶與監管機構完成現場審計。
支原體檢測 NAT 法驗證報告需包含檢測限、專屬性、耐用性等完整數據。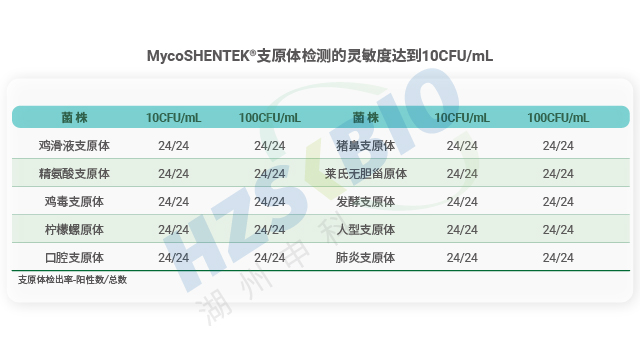
湖州申科的支原體培養法樣品檢測流程嚴格遵循 USP 標準,步驟規范且邏輯嚴謹。接種環節:每 100mL 液體培養基接種 10mL 供試品,每類固體培養基接種 0.2mL 供試品;培養條件:置于 36±1℃、5-10% CO?的濕潤環境中培養 28 天。繼代培養需在特定時間點開展:接種后第 2-4 天、第 6-8 天、第 13-15 天、第 19-21 天,每次從每種液體培養基中吸取至少 0.2mL,接種至對應固體培養基繼續培養不少于 14 天,其中第 20-21 天的繼代培養需持續 7 天。觀察頻率為每 2-3 天一次,若液體培養物出現顏色變化,需立即進行繼代培養,再通過與陰陽性對照培養基的對比,完成結果判定,確保檢測無遺漏、無偏差。
申科依托 CNAS 認證實驗室提供支原體檢測服務,可配合監管機構現場審計,確保合規性。北京細胞療法產品支原體檢測方法學驗證實驗室需分區操作支原體檢測,避免陰陽性樣本交叉污染,配備單獨耗材。吉林疫苗產品支原體檢測使用性驗證
長期以來,支原體檢測主要依賴培養法和指示細胞法,且法規通常要求兩種方法同時使用,但這兩類方法存在明顯短板——培養法檢測周期長達 28 天,指示細胞法也需較長時間等待結果。隨著細胞療法藥物快速發展,其上市周期短、貨架期有限的特點,使得傳統方法難以滿足藥物放行的時效要求。核酸擴增技術(NAT)尤其是熒光探針 qPCR 檢測方法的出現,憑借檢測速度快、特異性強的優勢,成為支原體檢測的理想替代方案。作為替代方法,NAT 檢測需通過嚴格驗證以達到法規要求的靈敏度:檢測限達到 10CFU/mL 可替代培養法,達到 100CFU/mL 可替代指示細胞培養法,從而實現快速且可靠的支原體篩查。
吉林疫苗產品支原體檢測使用性驗證
上一篇
上海高效熱原檢測風險評估
下一篇:
湖北干細胞產品支原體檢測國產替代
相關新聞
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- PG13宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-12-19
- CHO宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-12-19
- 北京高效內毒素檢測商業化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
- 江蘇生物制品內毒素檢測重組級聯試劑(rCR) 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測 2025-12-19
- 浙江定制化宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證 2025-12-19
- SV40LTA&E1A宿主細胞殘留DNA檢測 2025-12-19
- 江蘇細菌內毒素檢測結果判定 2025-12-19
推薦新聞
- 海南哪里有醫用高分子夾板技術指導 2025-12-20
- 浦東新區聚甲醛誠信合作 2025-12-20
- 昆山瑞克式助聽器上門驗配 2025-12-20
- 成都輕便上臂假肢 2025-12-20
- 奉賢區運用實驗儀器專賣店 2025-12-20
- 崇明區作用實驗儀器市價 2025-12-20
- 稱量分離細胞培養皿 2025-12-20
- DNA植絨拭子批發廠 2025-12-20
- 1-溴-2-芐氧基乙烷報價 2025-12-20
- 上海隱形助聽器定制 2025-12-20