江蘇抗體藥物內(nèi)毒素檢測(cè)技術(shù)服務(wù)
來(lái)源:
發(fā)布時(shí)間:2025-12-15
重組級(jí)聯(lián)試劑(rCR)通過(guò)完整模擬天然鱟試劑的酶促級(jí)聯(lián)反應(yīng)路徑,實(shí)現(xiàn)高效且特異的內(nèi)毒素檢測(cè)。其反應(yīng)機(jī)制為:內(nèi)毒素首先活化重組 C 因子,活化的 C 因子進(jìn)一步活化重組 B 因子,隨后活化重組凝固酶原轉(zhuǎn)化為凝固酶,再催化顯色底物產(chǎn)生黃色信號(hào)(405nm 波長(zhǎng)可檢測(cè))。這一級(jí)聯(lián)放大過(guò)程有效提升了檢測(cè)靈敏度,即使微量?jī)?nèi)毒素也能產(chǎn)生可識(shí)別信號(hào)。與單因子的重組 C 因子法(rFC)相比,rCR 的多因子級(jí)聯(lián)反應(yīng)抗干擾能力更強(qiáng),尤其對(duì)復(fù)雜基質(zhì)樣品(如高蛋白單抗、疫苗)表現(xiàn)更優(yōu)。同時(shí),rCR 剔除了天然鱟試劑中的 G 因子,避免了與 β-D 葡聚糖的非特異性反應(yīng),從根本上減少假陽(yáng)性結(jié)果,保障檢測(cè)數(shù)據(jù)的可靠性。
凝膠法鱟試劑通過(guò)觀察凝膠形成定性內(nèi)毒素,操作簡(jiǎn)便,適合醫(yī)療器械內(nèi)毒素檢測(cè)初篩。江蘇抗體藥物內(nèi)毒素檢測(cè)技術(shù)服務(wù)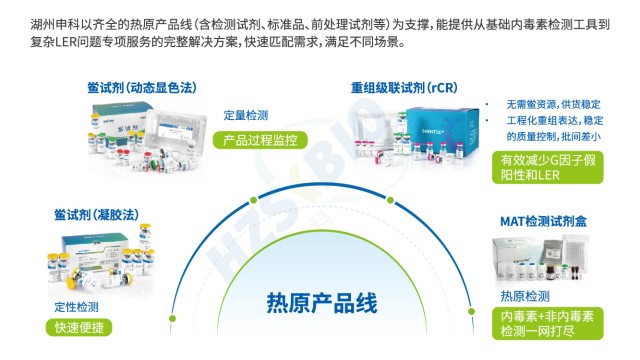
鱟試驗(yàn)法(LAL 法)是細(xì)菌內(nèi)毒素檢測(cè)的經(jīng)典方法,依據(jù)反應(yīng)監(jiān)測(cè)方式可分為三類:凝膠法、濁度法和顯色法。凝膠法通過(guò)觀察是否形成凝膠判斷內(nèi)毒素是否超標(biāo),其優(yōu)勢(shì)是操作簡(jiǎn)便、成本較低,適用于定性或半定量檢測(cè),如醫(yī)療器械初篩;濁度法通過(guò)監(jiān)測(cè)反應(yīng)體系濁度變化速率定量?jī)?nèi)毒素,靈敏度高(可達(dá) 0.005 EU/mL),適用于生物制品原液等高精度需求場(chǎng)景;顯色法基于顯色底物的吸光度變化定量,抗干擾能力較強(qiáng),適配復(fù)雜基質(zhì)樣品(如含蛋白質(zhì)的注射液)。三種方法均需嚴(yán)格控制反應(yīng)溫度(37℃±1℃)和時(shí)間,確保結(jié)果可靠性。
江蘇抗體藥物內(nèi)毒素檢測(cè)技術(shù)服務(wù)鱟試劑靈敏度復(fù)核至關(guān)重要,存放半年需重測(cè),避免內(nèi)毒素檢測(cè)出現(xiàn)假陰性或假陽(yáng)性。
湖州申科生物動(dòng)態(tài)顯色法鱟試劑用于定量測(cè)定人用和動(dòng)物用注射藥物、生物制品及醫(yī)療器械等樣本中的細(xì)菌內(nèi)毒素的含量。 細(xì)菌內(nèi)毒素能特異性地活化反應(yīng)主劑中的 C 因子,活化的 C 因子活化 B 因子,活化的 B 因子進(jìn)而活化凝固酶原,凝固酶水解反應(yīng)中的顯色底物,產(chǎn)生游離的pNA(對(duì)硝基苯胺)從而引起吸光度變化,根據(jù)動(dòng)態(tài)檢測(cè)溶液吸光度變化率對(duì)內(nèi)毒素進(jìn)行定量。本品能夠快速、高靈敏度地定量檢測(cè)樣品中的內(nèi)毒素水平,適用于各種實(shí)驗(yàn)室和工業(yè)生產(chǎn)場(chǎng)景,確保產(chǎn)品質(zhì)量和安全性。
低內(nèi)毒素回收(LER)與傳統(tǒng)鱟試劑干擾(抑制 / 增強(qiáng))在多維度存在差異,準(zhǔn)確區(qū)分對(duì)優(yōu)化內(nèi)毒素檢測(cè)至關(guān)重要。表現(xiàn)上,LER 是內(nèi)毒素回收率<50%,傳統(tǒng)干擾是反應(yīng)抑制或增強(qiáng);成因上,LER 由螯合劑 + 表面活性劑協(xié)同或蛋白質(zhì)電荷結(jié)合引發(fā),傳統(tǒng)干擾因 pH、β- 葡聚糖等導(dǎo)致;排除方式上,LER 時(shí)間依賴且無(wú)法稀釋解決,傳統(tǒng)干擾濃度依賴且可通過(guò)稀釋緩解;確認(rèn)方法上,LER 需通過(guò)保存時(shí)間研究(HTS),傳統(tǒng)干擾按藥典干擾實(shí)驗(yàn)評(píng)估。明確這些區(qū)別能幫助企業(yè)排查內(nèi)毒素檢測(cè)異常,避免誤將 LER 當(dāng)作普通干擾處理。
鱟試劑含多種酶和輔助因子,批次間活性差異可能導(dǎo)致內(nèi)毒素檢測(cè)結(jié)果變異性。
針對(duì)單核細(xì)胞活化反應(yīng)測(cè)定法(MAT)通過(guò)檢測(cè)內(nèi)毒素的生物活性,有效規(guī)避低內(nèi)毒素回收(LER)對(duì)內(nèi)毒素檢測(cè)的影響。其原理是:熱原(包括被掩蔽的 LPS)活化單核細(xì)胞表面的 TLR 受體,釋放 IL-6 等細(xì)胞因子,通過(guò) ELISA 檢測(cè) IL-6 濃度,結(jié)合標(biāo)準(zhǔn)曲線推算熱原含量。即使 LPS 因 LER 改變超分子結(jié)構(gòu),只要仍具生物活性,就能被 MAT 法識(shí)別。這種 “檢測(cè)活性而非結(jié)構(gòu)” 的特性,使 MAT 法成為 LER 場(chǎng)景下內(nèi)毒素檢測(cè)的重要補(bǔ)充,與其他方法協(xié)同構(gòu)建高效可靠的熱原防控體系。
重組鱟試劑無(wú)動(dòng)物源,支持 3R 原則,批次差異小,適配動(dòng)態(tài)顯色法酶標(biāo)儀。廣東內(nèi)毒素檢測(cè)技術(shù)升級(jí)內(nèi)毒素檢測(cè)方法學(xué)驗(yàn)證需覆蓋線性、精密度,確保不同批次檢測(cè)結(jié)果穩(wěn)定。江蘇抗體藥物內(nèi)毒素檢測(cè)技術(shù)服務(wù)
如何準(zhǔn)備樣品進(jìn)行內(nèi)毒素檢測(cè)呢?測(cè)試前,需要根據(jù)樣品實(shí)際情況進(jìn)行樣本前處理。大多數(shù)樣品只需要稀釋,使用內(nèi)毒素檢測(cè)試劑盒進(jìn)行測(cè)試即可。如果樣品有蛋白酶干擾并導(dǎo)致假陽(yáng)性結(jié)果,建議對(duì)樣品稀釋并70°C加熱5-15分鐘進(jìn)行熱滅活處理。如需要,可以對(duì)滅活樣品進(jìn)行進(jìn)一步稀釋后檢測(cè)。如果樣品可能含有受β-葡聚糖,建議使用抗增液。β-葡聚糖可能來(lái)自酵母和纖維素材料。如果樣品中因含有內(nèi)毒素結(jié)合物而存在抑制,可以嘗試使用分散劑。
江蘇抗體藥物內(nèi)毒素檢測(cè)技術(shù)服務(wù)
相關(guān)新聞
- 上海高效熱原檢測(cè)MAT試劑盒 2025-12-19
- PG13宿主細(xì)胞蛋白(HCP)殘留檢測(cè)常見(jiàn)問(wèn)題分析 2025-12-19
- CHO宿主細(xì)胞蛋白(HCP)殘留檢測(cè)方法學(xué)驗(yàn)證 2025-12-19
- 北京高效內(nèi)毒素檢測(cè)商業(yè)化試劑盒 2025-12-19
- 北京通用型宿主細(xì)胞蛋白(HCP)殘留檢測(cè)抗體制備 2025-12-19
- 江蘇生物制品內(nèi)毒素檢測(cè)重組級(jí)聯(lián)試劑(rCR) 2025-12-19
- 北京通用型宿主細(xì)胞蛋白(HCP)殘留檢測(cè) 2025-12-19
- 浙江定制化宿主細(xì)胞蛋白(HCP)殘留檢測(cè)抗體覆蓋率驗(yàn)證 2025-12-19
- SV40LTA&E1A宿主細(xì)胞殘留DNA檢測(cè) 2025-12-19
- 江蘇細(xì)菌內(nèi)毒素檢測(cè)結(jié)果判定 2025-12-19
推薦新聞
- 四川影像的采集錄制醫(yī)學(xué)影像工作站24小時(shí)服務(wù) 2025-12-20
- 天津高性價(jià)比QS-21現(xiàn)貨供應(yīng) 2025-12-20
- 新疆Fab合成文庫(kù)公司推薦 2025-12-20
- 河南CRET技術(shù)CD因子檢測(cè) 2025-12-20
- 南京進(jìn)口的全自動(dòng)核酸提取儀批發(fā)廠家 2025-12-20
- PCM170表面污染測(cè)量?jī)x 2025-12-20
- 廣西電池模組制造 2025-12-20
- 南通國(guó)內(nèi)智能醫(yī)療穿戴設(shè)備規(guī)劃 2025-12-20
- 作用六字真言香囊地方 2025-12-20
- 上海定制式助聽(tīng)器多少錢 2025-12-20