推薦新聞
上海非動物源內毒素檢測動態顯色法鱟試劑
來源:
發布時間:2025-12-18
當實驗室更換內毒素檢測方法或更換試劑供應商時,需進行方法比對與橋接驗證。比對實驗需選取至少 3批代表性樣品,分別用新舊方法檢測,計算結果相關性(如相關系數 R2≥0.95)和偏差(≤20%)。橋接驗證還需評估新方法的特異性、靈敏度是否與舊方法一致,如確認對高風險樣品(如含 β- 葡聚糖的樣品)的抗干擾能力相當。若方法變更涉及法規申報產品,需將驗證數據納入申報資料,證明變更后方法仍能有效控制內毒素風險,符合 FDA、NMPA 等監管機構對方法變更的合規性要求。
“低內毒素回收(LER)”可能導致內毒素檢測假陰性,對患者用藥安全構成潛在隱患。上海非動物源內毒素檢測動態顯色法鱟試劑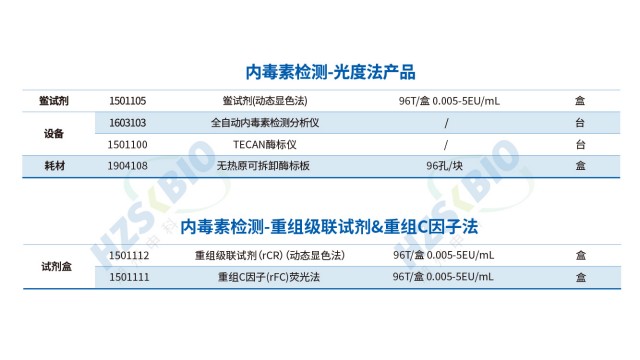
湖州申科生物動態顯色法鱟試劑用于定量測定人用和動物用注射藥物、生物制品及醫療器械等樣本中的細菌內毒素的含量。 細菌內毒素能特異性地活化反應主劑中的 C 因子,活化的 C 因子活化 B 因子,活化的 B 因子進而活化凝固酶原,凝固酶水解反應中的顯色底物,產生游離的pNA(對硝基苯胺)從而引起吸光度變化,根據動態檢測溶液吸光度變化率對內毒素進行定量。本品能夠快速、高靈敏度地定量檢測樣品中的內毒素水平,適用于各種實驗室和工業生產場景,確保產品質量和安全性。
上海非動物源內毒素檢測動態顯色法鱟試劑繪制內毒素標準曲線時,起始濃度需統一為 1000EU/mL,避免稀釋誤差。
鱟試驗法(LAL 法)是細菌內毒素檢測的經典方法,依據反應監測方式可分為三類:凝膠法、濁度法和顯色法。凝膠法通過觀察是否形成凝膠判斷內毒素是否超標,其優勢是操作簡便、成本較低,適用于定性或半定量檢測,如醫療器械初篩;濁度法通過監測反應體系濁度變化速率定量內毒素,靈敏度高(可達 0.005 EU/mL),適用于生物制品原液等高精度需求場景;顯色法基于顯色底物的吸光度變化定量,抗干擾能力較強,適配復雜基質樣品(如含蛋白質的注射液)。三種方法均需嚴格控制反應溫度(37℃±1℃)和時間,確保結果可靠性。
檢測細菌內毒素的堂試劑方法,是一個生物反應過程,受到很多因素的干擾。在一個供試品的檢測方法固定下來之前,為了得到準確的結果,必須要了解供試品與鱟試劑之間的相互關系。供試品中的成分往往非常復雜,而且會干擾試驗檢測系統的功能。很多干擾的機理,并不是非常清楚。但是業界比較能夠接受的理論是,如果供試品中某些因子影響了鱟試劑中蛋白的表達功能,則被認為是干擾作用(Inhibition/Enhancement,V/E)。干擾作用產生的因素較多,一般包括試劑因素(鱟試劑、內毒素標準品)供試品因素(pH值、溫度、離子強度、濃度、水溶性、黏度、可發生鱟試劑反應的非內毒素雜質)和實驗因素(試驗器皿、細菌內毒素檢查用水、鱟試劑抗干擾能力)等。
進行重組級聯試劑時,不同酶標儀檢測樣本 Onset time 有差異,因信號采集方式和靈敏度不同。
內毒素檢測方法驗證需覆蓋多項參數,確保方法可靠:線性范圍需包含樣品預期濃度(如 0.01-10 EU/mL),相關系數 R2≥0.98;準確度通過加標回收率評估,應在 50%-200% 范圍內;精密度包括批內和批間精密度,CV 值均應≤15%;檢測限(LOD)需低于產品限值的 1/2(如限值 0.5 EU/mL,LOD 應≤0.25 EU/mL);專屬性需證明無干擾物質影響(如 β- 葡聚糖、蛋白質不引發假陽性)。驗證通過后,方法需經實驗室負責人批準方可使用,且定期需進行一次回顧性驗證,確認方法持續有效。
重組鱟試劑無動物源,支持 3R 原則,批次差異小,適配動態顯色法酶標儀。上海重組蛋白內毒素檢測LER現象外源性熱原含細菌內毒素、脂磷壁酸、酵母多糖等,單核細胞活化反應檢查法可檢出全部熱原。上海非動物源內毒素檢測動態顯色法鱟試劑
內毒素檢測方法易受樣品基質干擾,法規要求在方法應用前必須進行干擾驗證,選擇標準曲線中點或一個靠近中點的內毒素濃度,作為供試品干擾試驗種添加的內毒素濃度計算回收率,若回收率在 50%-200% 范圍內,表明無明顯干擾;若回收率異常,需通過過濾、中和、透析、加熱處理等方式優化樣品前處理。方法學確認還需涵蓋線性范圍(如 0.005-5 EU/mL)、精密度(批內 CV≤15%)、檢測限(LOD≤0.01 EU/mL)等指標,確保方法在實際樣品檢測中穩定可靠,符合《美國藥典》 <85>、《中國藥典》通則 1143 等藥典要求。
上海非動物源內毒素檢測動態顯色法鱟試劑
相關新聞
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- 北京高效內毒素檢測商業化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
- 江蘇生物制品內毒素檢測重組級聯試劑(rCR) 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測 2025-12-19
- 浙江定制化宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證 2025-12-19
- SV40LTA&E1A宿主細胞殘留DNA檢測 2025-12-19
- 江蘇細菌內毒素檢測結果判定 2025-12-19
- 上海通用型宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-12-19
- 北京ELISA法宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
推薦新聞
- 吳江區服務軟霧吸入器加盟連鎖店 2025-12-19
- 松江區定制吻合器工廠直銷 2025-12-19
- 深圳醫院智慧管理系統多少錢一套 2025-12-19
- 山西疫苗佐劑QS-21 2025-12-19
- 姑蘇區常見一次性注射器資費 2025-12-19
- 武漢本地活細胞成像分析系統直銷價格 2025-12-19
- 附近哪里有助腿器誠信合作 2025-12-19
- 銀杏葉片工廠 2025-12-19
- 珠海有實力的nmn定制廠家 2025-12-19
- 廣東耳鼻喉醫學影像工作站歡迎選購 2025-12-19