北京ELISA法宿主細胞蛋白(HCP)殘留檢測抗體制備
來源:
發布時間:2025-12-19
昆蟲細胞桿狀病毒表達系統(IC-BEVS)是一種真核表達系統,以桿狀病毒為外源基因載體,以昆蟲細胞為宿主實現外源蛋白的生產。該系統具備便于規模化生產、培養成本低、生物安全性高等優勢,近年已逐步應用于重組蛋白、rAAV 載體、亞單位疫苗(如病毒樣顆粒(VLP)疫苗)等產品的生產,在生物制品重組蛋白表達領域已得到廣泛應用。Sf9 細胞系源自草地夜蛾細胞系(Spodoptera frugiperda cell line,簡稱 Sf),是當前較為常用的昆蟲細胞系之一。SHENTEK® Sf9 HCP 殘留蛋白檢測試劑盒(一步酶聯免疫吸附法),可對采用 Sf9 細胞系生產的生物制品中宿主細胞蛋白(HCP)殘留進行定量檢測。該試劑盒的抗體覆蓋率分別為 70.4%-96.0%(采用 IMBS-2D 法)和 91.2%(采用 IMBS-MS 法,Unique Peptide ≥2)。
抗體覆蓋率水平因技術平臺而異,其高低排序通常為 IMBS-MS 、IMBS-2D 、2D-Western Blot。北京ELISA法宿主細胞蛋白(HCP)殘留檢測抗體制備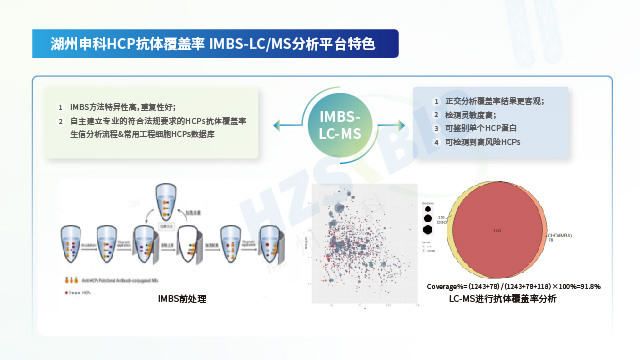
湖州申科生物CHO-K1HCP殘留檢測試劑盒(一步酶聯免疫吸附法),采用固相酶聯免疫吸附法原理,可對CHO-K1細胞生產的生物制品中宿主殘留蛋白進行定量檢測。檢測時,向預包被抗CHO-K1HCPs綿羊多抗的酶標板中,加入校準品或待測樣品、HRP標記的抗CHO-K1HCPs綿羊多抗共同孵育。洗滌后加入TMB底物顯色,隨后用終止液終止酶促反應;再用酶標儀在450nm波長下測定吸光度,該吸光度與校準品或待測樣品中HCPs濃度呈正相關,依據校準品擬合的劑量-反應曲線,即可算出待測樣品中HCPs的濃度。該試劑盒對待測樣品無需特殊處理,通過合適稀釋比例的適用性驗證,即可直接使用。且試劑盒操作步驟少、檢測快速,同時具備專一性強、性能穩定可靠的特點。
北京ELISA法宿主細胞蛋白(HCP)殘留檢測抗體制備湖州申科系列宿主細胞蛋白(HCP)殘留檢測產品,均完成校準品表征與抗體覆蓋率兩項關鍵分析工作。
美國藥典 USP 通則 <1132.1>《質譜法測定生物藥中殘留宿主細胞蛋白》(Residual Host Cell Protein Measurement in Biopharmaceuticals by Mass Spectrometry),主要內容是介紹 LC-MS 技術在宿主細胞殘留蛋白檢測中的應用。該通則圍繞樣品制備、質譜測試條件建立、數據分析、質譜方法驗證等維度,詳細說明質譜技術應用于 HCPs 檢測的優勢及需注意的事項。作為先進的分析技術平臺,質譜技術在 HCPs 分析中的應用,無論是單獨使用,還是與 ELISA 及其他分析方法聯合使用,都能幫助生產企業在產品全生命周期中更清晰地理解并建立 HCPs 檢測方法,進而保障產品質量穩定。
樣品質量是影響宿主細胞蛋白(HCP)殘留檢測結果的因素之一。HCP 檢測覆蓋生物制品生產全流程,包含收獲、純化、制備等多個環節,不同樣品基質會導致 HCP 檢測結果存在明顯差異。以含佐劑的疫苗為例,佐劑會產生干擾,導致成品中難以檢測 HCP,因此通常在吸附工藝前的原液階段開展檢測。此外,樣品的收集、處理及保存方式也對檢測結果有重要影響。處理方式不當可能造成蛋白降解或變性,進而影響檢測結果。比如將歷史批樣品用作內部質控品時,需結合其穩定性數據,合理設定保存條件與保存期限,以此保障檢測方法的準確性和穩定性。
宿主細胞蛋白(HCP)殘留檢測,是保障生物制品安全及有效性的關鍵所在。
湖州申科生物專注于研發貼合實際生產工藝的商業化宿主細胞蛋白(HCP)殘留檢測試劑盒,依托不同工藝下 HCP 的差異化分析,針對性推出各細分工藝領域的 HCP 檢測試劑盒。實驗數據顯示:針對 CHO-S 與 CHO-K1 兩種宿主細胞,兩類細胞共享 2458 種相同 HCP(占比 79.7%),但各自存在 392 種和 236 種特異性 HCP,充分體現工藝差異帶來的殘留蛋白特異性。進一步對比 B3 表達菌與 K2 克隆菌,盡管二者共享 1489 種相同蛋白(分別占比 88% 和 85%),但仍各自檢出 208 種和 258 種獨有蛋白,差異率為 12%-15%。這些結果直接證實,不同工藝路線與克隆株選擇會影響 HCP 殘留譜的構成。據此,湖州申科提出 “工藝定制化檢測” 策略:通過準確識別共性與特異性 HCP,針對性研發細分試劑盒產品。
線性范圍、中間精密度、靈敏度等關鍵參數的評估,是 HCP 檢測方法驗證的必備環節。北京工藝特異型宿主細胞蛋白(HCP)殘留檢測免疫策略對 宿主細胞蛋白(HCP)抗體的關鍵要求是識別工藝 HCP、規避優勢聚集,且突出潛在高風險 HCP 的識別能力。北京ELISA法宿主細胞蛋白(HCP)殘留檢測抗體制備
為更優管控工藝、保障產品質量穩定,各國監管機構均要求提供所用宿主細胞蛋白(HCP)殘留檢測ELISA試劑盒的抗體覆蓋率數據。通常需開展覆蓋率分析的場景主要有以下四類:①臨床II期后,若仍使用商品化試劑盒,需評估其抗體覆蓋率是否能持續滿足質量監控需求;②臨床III期及后續階段,若產品研究者開發了平臺化或工藝專屬型HCP監測方法,此類試劑盒使用前需評估其覆蓋率水平與商業化試劑盒覆蓋率水平的差異;③申報階段若未提交覆蓋率數據,監管機構可能向企業提出補充提交的要求;④產品上市后,若發生生產場地變更、工藝變更、HCP分析方法變更等情況,研究者需評估變更前后抗體覆蓋率水平的差異,以及該差異對藥品質量與安全性的影響。
北京ELISA法宿主細胞蛋白(HCP)殘留檢測抗體制備
相關新聞
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- PG13宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-12-19
- CHO宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-12-19
- 北京高效內毒素檢測商業化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
- 江蘇生物制品內毒素檢測重組級聯試劑(rCR) 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測 2025-12-19
- 浙江定制化宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證 2025-12-19
- SV40LTA&E1A宿主細胞殘留DNA檢測 2025-12-19
- 江蘇細菌內毒素檢測結果判定 2025-12-19
推薦新聞
- 洛龍口碑好的老年護理機構 2025-12-20
- 國內固定式車輛通道監測儀儀器維修 2025-12-20
- 濃縮銀杏的功效與作用 2025-12-20
- 福建智能聯網智能醫廢管理收集車直銷廠家 2025-12-20
- 什么是生物檢測試劑盒歡迎選購 2025-12-20
- 兒童青少年脊柱側彎支具24小時服務 2025-12-20
- 松江區國產生物檢測試劑盒 2025-12-20
- 山東效果助膝器怎么樣 2025-12-20
- 吉林包埋類型 2025-12-20
- 安徽無紡布加減孔膠帶廠家直供 2025-12-20