重組蛋白內毒素檢測凝膠法鱟試劑
來源:
發布時間:2025-09-29
內毒素檢測結果誤差可能源于多環節:試劑方面,鱟試劑(LAL )或試劑批間差異、過期試劑活性下降會導致結果偏差,需通過試劑驗收(如陽性對照回收率驗證)確保質量;操作方面,實驗器具未除熱原(如玻璃器皿未干熱滅菌)、加樣體積不準確會引入污染或誤差,需嚴格執行 SOP(如器皿 250℃干熱滅菌≥30 分鐘);環境方面,實驗室空氣中的微生物孢子、粉塵可能污染樣品,需在潔凈工作臺操作并設置陰性對照。此外,反應溫度波動(偏離 37℃±1℃)會影響酶活性,需使用恒溫孵育器精確控溫,確保反應條件穩定。
內毒素檢測中,脂多糖(LPS) 聚集體過度變小(近單體)可能降低檢測信號。重組蛋白內毒素檢測凝膠法鱟試劑
動態顯色法鱟試劑是湖州申科生物針對生產過程監控開發的內毒素檢測工具,兼具準確性和便利性。該試劑靈敏度達 0.005-5EU/mL,標準曲線 R2≥0.990,可準確定量內毒素濃度,滿足生物制品中間品和成品的放行需求。成套包裝設計包含內毒素標準品、檢查用水、主試劑復溶液、主反應試劑、96 孔板及封口膜,無需額外采購輔料,開箱即可使用,減少耗材浪費。穩定性上,批次間 CV 值≤15%,優于行業 20% 的平均水平,確保長期檢測數據的一致性。配套抗增液可有效應對蛋白質、多糖等基質干擾,加標回收率穩定在 80%-120%。操作上適配主流酶標儀,支持 405nm 動態讀數,數據可自動記錄追溯,符合 GMP 數據完整性要求。
廣東細菌內毒素檢測凝膠法鱟試劑細菌內毒素工作品若效價誤差或不穩定,將影響實驗結果。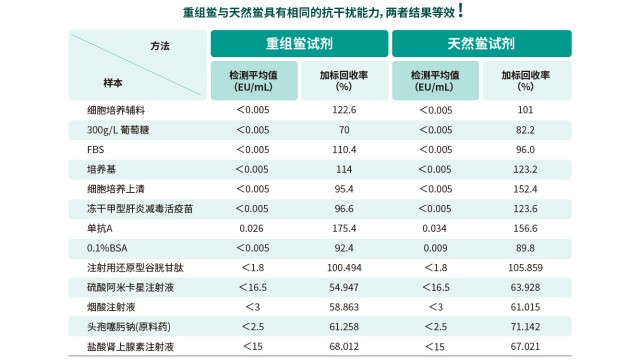
低內毒素回收(LER)又稱內毒素掩蔽,是指無菌制劑(尤其蛋白類生物制劑)進行內毒素檢測時,加標內毒素的回收率<50% 的現象,且無法通過稀釋排除,區別于傳統檢測干擾。LER 會導致內毒素污染被低估,已被全球監管機構重點關注:FDA 2013 年要求生物藥 BLA 申報時提交 LER 研究報告;EMA 2023 年明確含表面活性劑(如吐溫)或螯合劑(如 EDTA)的制劑需提供 LER 數據;中國藥典 2025 版 9251 通則也新增 LER 內容,與國際接軌。這些要求促使企業優化內毒素檢測流程,避免因 LER 導致的檢測偏差,確保藥品安全。
隨著動物保護理念和法規要求升級,重組因子C法(rFC法)作為 LAL 法的替代技術逐漸普及。重組 C 因子是以基因重組的方式表達的 LAL 試劑中的 C 因子,C 因子被內毒素活化后切割熒光底物產生游離熒光基團,通過檢測熒光信號可以反應活化后的蛋白酶活性,并由此可以推算出內毒素的含量。與傳統 LAL 法相比,rFC 法無需依賴鱟血資源,避免了天然 LAL 試劑批間差異大、易受 β- 葡聚糖干擾等問題,且反應特異性更強。目前,《美國藥典》、《歐洲藥典》等法規已收錄 rFC 法,歐盟更推薦其用于疫苗等高風險產品檢測,在保證檢測準確性的同時,符合動物福利和可持續發展要求。
內毒素檢測方法學驗證需覆蓋線性、精密度,確保不同批次檢測結果穩定。
低內毒素回收(LER)與傳統鱟試劑干擾(抑制 / 增強)在多維度存在差異,準確區分對優化內毒素檢測至關重要。表現上,LER 是內毒素回收率<50%,傳統干擾是反應抑制或增強;成因上,LER 由螯合劑 + 表面活性劑協同或蛋白質電荷結合引發,傳統干擾因 pH、β- 葡聚糖等導致;排除方式上,LER 時間依賴且無法稀釋解決,傳統干擾濃度依賴且可通過稀釋緩解;確認方法上,LER 需通過保存時間研究(HTS),傳統干擾按藥典干擾實驗評估。明確這些區別能幫助企業排查內毒素檢測異常,避免誤將 LER 當作普通干擾處理。
內毒素指示劑(ECV)是凍干脂多糖,監測制藥工藝高溫除內毒素效果。廣東細菌內毒素檢測凝膠法鱟試劑內毒素工作標準品(CSE)稀釋液配制時渦旋很重要,可使內毒素充分溶解,保證濃度準確。重組蛋白內毒素檢測凝膠法鱟試劑
檢測細菌內毒素的堂試劑方法,是一個生物反應過程,受到很多因素的干擾。在一個供試品的檢測方法固定下來之前,為了得到準確的結果,必須要了解供試品與鱟試劑之間的相互關系。供試品中的成分往往非常復雜,而且會干擾試驗檢測系統的功能。很多干擾的機理,并不是非常清楚。但是業界比較能夠接受的理論是,如果供試品中某些因子影響了鱟試劑中蛋白的表達功能,則被認為是干擾作用(Inhibition/Enhancement,V/E)。干擾作用產生的因素較多,一般包括試劑因素(鱟試劑、內毒素標準品)供試品因素(pH值、溫度、離子強度、濃度、水溶性、黏度、可發生鱟試劑反應的非內毒素雜質)和實驗因素(試驗器皿、細菌內毒素檢查用水、鱟試劑抗干擾能力)等。
重組蛋白內毒素檢測凝膠法鱟試劑
下一篇:
江蘇醫療器械內毒素檢測常見問題分析
相關新聞
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- PG13宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-12-19
- CHO宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-12-19
- 北京高效內毒素檢測商業化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
- 江蘇生物制品內毒素檢測重組級聯試劑(rCR) 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測 2025-12-19
- 浙江定制化宿主細胞蛋白(HCP)殘留檢測抗體覆蓋率驗證 2025-12-19
- SV40LTA&E1A宿主細胞殘留DNA檢測 2025-12-19
- 江蘇細菌內毒素檢測結果判定 2025-12-19
推薦新聞
- 四川影像的采集錄制醫學影像工作站24小時服務 2025-12-20
- 天津高性價比QS-21現貨供應 2025-12-20
- 新疆Fab合成文庫公司推薦 2025-12-20
- 河南CRET技術CD因子檢測 2025-12-20
- 南京進口的全自動核酸提取儀批發廠家 2025-12-20
- PCM170表面污染測量儀 2025-12-20
- 廣西電池模組制造 2025-12-20
- 南通國內智能醫療穿戴設備規劃 2025-12-20
- 作用六字真言香囊地方 2025-12-20
- 上海定制式助聽器多少錢 2025-12-20