-
 北京非動物源熱原檢測體系
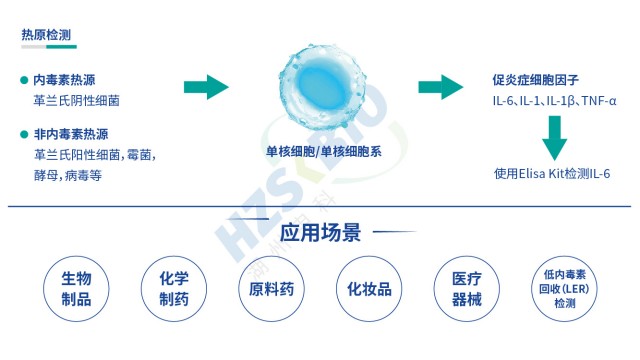
北京非動物源熱原檢測體系傳統熱原檢測方法的局限性十分明顯:鱟試驗法只能特異性識別細菌內毒素,對非內毒素熱原完全無響應;家兔熱原試驗雖能篩查全類型熱原,但靈敏度低(檢測限≥5EU/kg),無法檢出微量非內毒素熱原,且無法區分熱原類型,難以追溯污染源頭;單核細胞活化反應測定(MAT)的出現有效解決了上述難題,其關鍵優勢在于:基于人源單核細胞的免疫應答機制,可同時識別所有具備生物活性的熱原(包括內毒素與非內毒素),且檢測靈敏度高(對病毒熱原檢測限低至pg級);檢測周期短(24-48小時),可滿足產品快速放行需求;能通過細胞因子濃度定量評估熱原活性,避免“無活性熱原”的誤判。 選擇熱原檢測單核細胞活化反應測定法,即是選擇...
2025-10-03 -
 非動物源熱原檢測流程
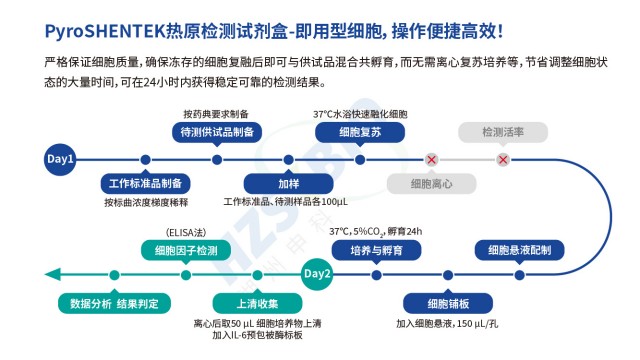
非動物源熱原檢測流程MAT法(單核細胞活化反應測定)熱原檢測基于人體免疫反應機制設計,原理是:內毒素(革蘭氏陰性菌來源)與非內毒素熱原(革蘭氏陽性菌、霉菌、病毒等來源)進入人體后,會活化單核細胞或單核細胞系,使其釋放 IL-6、IL-1、IL-1β、TNF-α 等促炎細胞因子。檢測時將供試品與單核細胞 / 單核細胞系共孵育,再通過 ELISA 定量檢測釋放的 IL-6 含量,結合內毒素標準品繪制的標曲,即可判斷供試品中熱原含量是否符合規定,實現內毒素與非內毒素熱原的全覆蓋檢測。 PyroSHENTEK 熱原檢測(MAT)試劑盒的單核細胞系無需供體,避免PBMC血源供應受限及標志物檢測環節。非動物源熱原檢測流程...
2025-10-03 -
 吉林熱原檢測法規要求
吉林熱原檢測法規要求PBMC(外周血單個核細胞)的供體差異會直接導致熱原檢測結果的波動,主要體現在 IL-6 釋放水平的不一致。不同供體的 PBMC,其單核細胞比例、TLR 受體表達量、免疫活性狀態存在差異:有的供體 PBMC 受熱原刺激后, IL-6 釋放量高;有的則極低,甚至無明顯響應。實驗數據顯示, PBMC 的標曲各濃度點相對偏差有高達 171.43%的,正是這種差異的體現,導致熱原檢測結果難以標準化,無法準確判斷供試品熱原是否超標,從而增加了藥品的質量控制風險。 PyroSHENTEK熱原檢測試劑盒采用“單核細胞+ELISA”標準化體系,檢測結果穩定、重復性好,數據準確。吉林熱原檢測法規要求 MA...
2025-10-03 -
 黑龍江熱原檢測常見問題分析
黑龍江熱原檢測常見問題分析PBMC(外周血單個核細胞)的供體差異會直接導致熱原檢測結果的波動,主要體現在 IL-6 釋放水平的不一致。不同供體的 PBMC,其單核細胞比例、TLR 受體表達量、免疫活性狀態存在差異:有的供體 PBMC 受熱原刺激后, IL-6 釋放量高;有的則極低,甚至無明顯響應。實驗數據顯示, PBMC 的標曲各濃度點相對偏差有高達 171.43%的,正是這種差異的體現,導致熱原檢測結果難以標準化,無法準確判斷供試品熱原是否超標,從而增加了藥品的質量控制風險。 生物制品的高蛋白、螯合劑基質易對鱟試驗產生抑制,rCR與MAT聯合策略可消除干擾并控制熱原。黑龍江熱原檢測常見問題分析 熱原檢測MAT法...
2025-10-03 -
 上海非動物源熱原檢測技術升級
上海非動物源熱原檢測技術升級MAT 法熱原檢測中,細胞傳代的代次控制是保障檢測穩定性的關鍵,需結合細胞特性與文獻數據制定標準。參考行業文獻,單核細胞系(如 HL-60、THP1)的使用代次通常不超過 20 代,代次過高會導致細胞生物學特性改變:一是 TLR 受體表達下降,如 TLR4 表達量在 20 代后下降 40%,導致內毒素檢測靈敏度降低;二是細胞倍增時間延長,從 24 小時延長至 36 小時,影響共培養時長的準確性;三是炎癥因子分泌減少,IL-6 分泌量在 20 代后下降 35%,導致熱原濃度低估。申科對配套的 HL-60 細胞系進行代次穩定性驗證,結果顯示:1-15 代細胞的熱原響應性一致(加標回收率 85%...
2025-10-03 -
 江蘇醫療器械熱原檢測流程
江蘇醫療器械熱原檢測流程單核細胞系憑借標準化、可控性等優勢,有效解決PBMC(外周血單個核細胞)在熱原檢測中的局限。其一,單核細胞系源自永生化細胞株(如 Mono-Mac-6),經篩選后細胞特性高度均一,消除供體差異,讓熱原檢測結果穩定性大幅提升。其二,其培養過程可控,培養基配方與環境(溫度、CO?濃度)可準確調控,能維持細胞好的活性,避免 PBMC 因分選、凍存導致的活性衰減。其三,對培養環境波動耐受性更強,可保障細胞遺傳穩定且無污染物風險,降低熱原檢測的操作復雜度與誤差率。 在藥品安全語境中,熱原特指細菌性熱原—微生物代謝產物、細菌尸體及內毒素的統稱。江蘇醫療器械熱原檢測流程 生物制品(如單克隆抗體、重組蛋...
2025-10-03 -
 熱原檢測技術服務
熱原檢測技術服務MAT法熱原檢測中,獲得標準 S 型標曲需通過顯色時機控制與圖形調整實現,確保標曲擬合準確。在顯色時機控制上,加入 TMB 底物后,孔內顏色會逐漸變藍,且隨反應時間加深,當標準品濃度梯度呈現明顯藍色差異(如高濃度孔深藍色、低濃度孔淺藍色)時,即可加入終止液;若儀器含 600nm 波長,可在終止前檢測高濃度標準品的 OD600nm 值,當達到 1.0 左右時終止,此時顯色反應處于線性期,終止后顏色由藍變黃,信號強度約增強 3 倍,易形成 S 型曲線。在圖形調整上,若標曲擬合后未呈現明顯 S 型,可通過調整坐標軸范圍優化—如將縱軸(OD 值)范圍設為 0-2.5,橫軸(熱原濃度)設為對數坐標,...
2025-10-03 -
 廣東熱原檢測商業化試劑盒
廣東熱原檢測商業化試劑盒隨著發熱反應分子機制研究的不斷深化,單核細胞活化試驗(MAT)作為一種體外熱原檢測技術,愈發受到醫藥與醫療器械行業的關注并逐步推廣應用。該方法的原理是:讓人體全血與待檢樣品中的熱原充分接觸后,通過檢測體系中產生的 IL-1β、IL-6(因穩定性強、重復性優,常作為關鍵檢測指標)、TNF 等促炎細胞因子含量,實現對熱原污染程度的評估,整個過程能高度模擬人體先天免疫系統對熱原的應答反應。相較于傳統熱原檢測手段,MAT 的優勢更為突出:不僅可檢出各類熱原污染物,包括尚未明確性質的未知熱原,以及革蘭氏陽性菌(脂磷壁酸)、真菌、病毒等產生的非內毒素熱原,填補了傳統內毒素檢測(如鱟試劑法)的覆蓋空白。...
2025-10-02 -
 上海高效熱原檢測技術服務
上海高效熱原檢測技術服務熱原是能引發恒溫動物體溫異常升高的物質總稱,主要成分為細菌內毒素(革蘭氏陰性菌脂多糖 LPS),同時涵蓋病毒、真菌毒素、支原體等非內毒素熱原,其檢測是保障藥品與醫療器械安全性的關鍵環節。當前熱原檢測已形成 “特異性檢測 + 廣譜篩查” 互補的完整體系:以鱟試驗法(含天然 LAL 與重組 rCR/rFC 試劑)作為細菌內毒素的特異性檢測手段,憑借 fg 級靈敏度成為制藥行業常規質控方法,可通過凝膠法實現定性、動態濁度 / 顯色法完成定量;以家兔熱原試驗作為傳統廣譜篩查方法,雖操作繁瑣(需預試篩選基礎體溫穩定家兔,正式試驗觀察 3 小時體溫變化),但仍是放射性質的藥物、血液制品等高風險產品排除...
2025-10-02 -
 黑龍江熱原檢測方法驗證
黑龍江熱原檢測方法驗證在 MAT 法熱原檢測中,PBMC(外周血單核細胞)與單核細胞系各有優劣,單核細胞系更適合標準化檢測。PBMC 的優勢在于免疫細胞成分豐富(含單核細胞、淋巴細胞等),對熱原反應敏感,靈敏度相對較高;但局限同樣明顯 ——PBMC 需從不同供體獲取,供體免疫狀態差異會導致檢測結果不穩定,且無法長期保存,難以建立標準化方法學。單核細胞系(如 HL-60、MM6、THP1)則克服了 PBMC 的局限:細胞來源穩定(可批量培養),TLR 受體表達覆蓋主要亞型(如 HL-60 表達 TLR1-TLR9),對熱原反應重復性好,更適合商業化試劑盒與法規檢測。不同單核細胞系性能也有差異:MM6/IL-6 法...
2025-10-02 -
 吉林非動物源熱原檢測
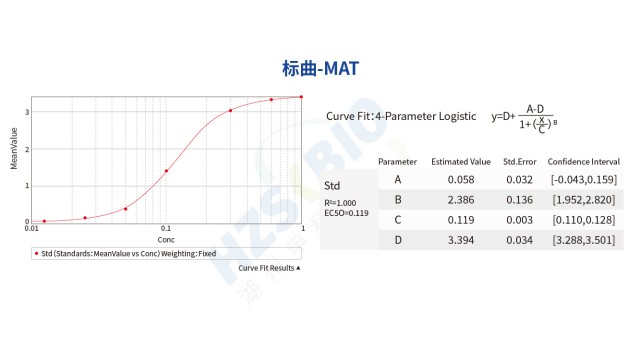
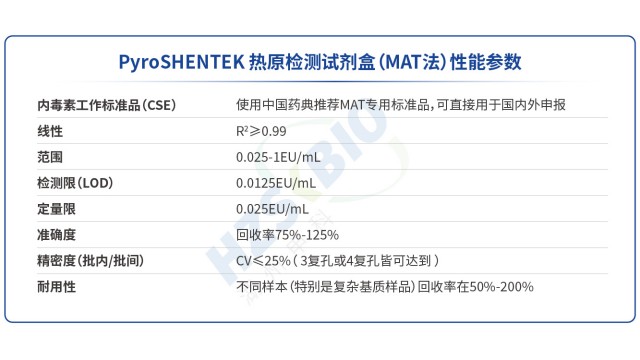
吉林非動物源熱原檢測PyroSHENTEK?熱原檢測試劑盒(貨號 1502100,規格 96 測試 / 盒)優勢在于搭載 MAT 特定單核細胞系,細胞表面表達多種 Toll 樣受體(TLR),可響應不同類型熱原。該細胞系來源清晰、可溯源,均一性強且無供體依賴,有效規避了傳統 PBMC 因供體差異導致的結果波動,同時安全風險低,無需擔憂外源因子污染。試劑盒采用 “標準化單核細胞 + ELISA 檢測” 一體化體系,通過嚴格的細胞質量控制(如凍存復融后活率達標),確保每次檢測的細胞狀態一致;搭配預包被 IL-6 抗體的酶標板與配套試劑,進一步減少體系誤差。從標曲數據來看,其擬合采用 4-Parameter Log...
2025-10-02 -
 北京化學制藥熱原檢測法規要求
北京化學制藥熱原檢測法規要求家兔熱原試驗作為熱原檢測領域的 “法定傳統方法”,被中國藥典(ChP)、美國藥典(USP)、歐洲藥典(EP)均列為法定檢測項目,其主要優勢在于可通過家兔體溫應答篩查所有類型熱原,尤其適用于無法排除非內毒素熱原污染的高風險產品,如血液制品、放射性質藥物及部分生物制劑。然而,家兔熱原試驗存在明顯局限:動物個體差異大,需額外投入時間與成本篩選合格家兔;檢測周期長(至少 6 小時),無法滿足生物制品快速放行需求;靈敏度較低(對 LPS 檢測限≥5EU/kg),與全球倡導的“動物福利3R原則”背道而馳。 MAT 法檢測革蘭氏陽性菌注射劑,需排查非內毒素熱原(如 LTA),避免只測內毒素漏檢。北京化學...
2025-10-02 -
 湖北血液制品熱原檢測
湖北血液制品熱原檢測熱原是能引發恒溫動物體溫異常升高的物質總稱,主要成分為細菌內毒素(革蘭氏陰性菌脂多糖 LPS),同時涵蓋病毒、真菌毒素、支原體等非內毒素熱原,其檢測是保障藥品與醫療器械安全性的關鍵環節。當前熱原檢測已形成 “特異性檢測 + 廣譜篩查” 互補的完整體系:以鱟試驗法(含天然 LAL 與重組 rCR/rFC 試劑)作為細菌內毒素的特異性檢測手段,憑借 fg 級靈敏度成為制藥行業常規質控方法,可通過凝膠法實現定性、動態濁度 / 顯色法完成定量;以家兔熱原試驗作為傳統廣譜篩查方法,雖操作繁瑣(需預試篩選基礎體溫穩定家兔,正式試驗觀察 3 小時體溫變化),但仍是放射性質的藥物、血液制品等高風險產品排除...
2025-10-02 -
 疫苗熱原檢測歐盟出口方案
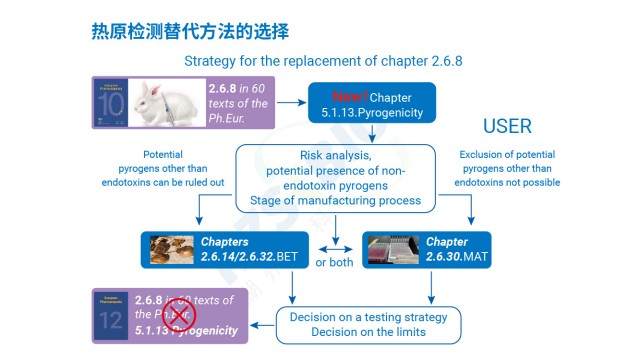
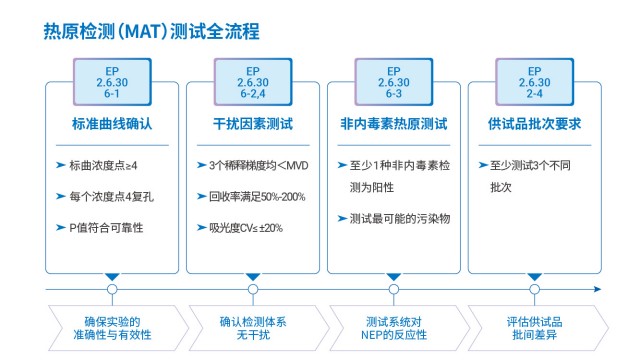
疫苗熱原檢測歐盟出口方案歐盟在熱原檢測方法選擇上,以動物保護和檢測準確性為導向,形成明確的法規傾向。首先,歐盟禁止家兔法(PRT 法)這類動物實驗,要求采用替代方法,單核細胞活化試驗(MAT 法)因符合 3R 原則(替代、減少、優化),被納入歐洲藥典(EP2.6.30),成為熱原檢測的主流替代方法。其次,對于鱟試劑法,歐盟雖未禁止(因其屬于鱟血提取而非動物實驗),但出于鱟資源保護考量,推薦使用重組 C 因子法(EP2.6.32),該方法無需依賴鱟血,通過基因工程技術制備試劑,避免資源衰減與生態爭議。此外,美國藥典(USP)和日本藥典(JP)也同步推薦重組試劑(含重組級聯試劑 rCR),形成國際法規協同趨勢。需注意...
2025-10-02 -
 浙江抗體藥物熱原檢測
浙江抗體藥物熱原檢測PBMC(外周血單個核細胞)的供體差異會直接導致熱原檢測結果的波動,主要體現在 IL-6 釋放水平的不一致。不同供體的 PBMC,其單核細胞比例、TLR 受體表達量、免疫活性狀態存在差異:有的供體 PBMC 受熱原刺激后, IL-6 釋放量高;有的則極低,甚至無明顯響應。實驗數據顯示, PBMC 的標曲各濃度點相對偏差有高達 171.43%的,正是這種差異的體現,導致熱原檢測結果難以標準化,無法準確判斷供試品熱原是否超標,從而增加了藥品的質量控制風險。 MAT 熱原檢測中細胞活性影響巨大,活率需達一定標準保證檢測效果。浙江抗體藥物熱原檢測 MAT 試劑盒配套的即用型細胞存在明確的傳代限制...
2025-10-02 -
 江蘇非動物源熱原檢測常見問題分析
江蘇非動物源熱原檢測常見問題分析PBMC(外周血單個核細胞)的復雜制備流程嚴重制約熱原檢測效率。首先,血源獲取受獻血者數量、時間及采集血液政策限制,無法按需即時獲取;其次,需嚴格執行 EP2.6.30 規定的標志物檢測,增加前期準備時間;再進行采集血液、分離單核細胞、凍存等環節需全程無菌操作,步驟繁瑣且易引入污染風險。相比之下,單核細胞系可工業化培養,制備流程簡單可控,能快速提供合格細胞,避免因 PBMC 制備延誤熱原檢測進度,更適配批量樣品的高效質控。單核細胞系傳代可控,20代以內TLR表達與炎癥因子分泌保持穩定,確保熱原響應一致性。江蘇非動物源熱原檢測常見問題分析 MAT 試劑盒配套的即用型細胞存在明確的傳代限制,且商...
2025-10-01 -
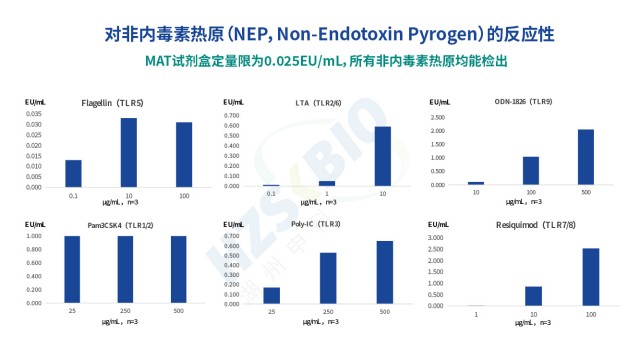 高效熱原檢測合規申報
高效熱原檢測合規申報MAT法熱原檢測中,ELISA 加終止液后的讀數時間需嚴格控制,以保障 IL-6 檢測信號穩定。湖州申科生物MAT試劑盒說明書明確要求,終止液添加后需在 10 分鐘內完成讀數,且需避光操作 —— 原因在于,終止液(如硫酸)會終止 TMB 顯色反應,但生成的黃色產物在光照下易降解,超過 10 分鐘后 OD 值會下降,導致 IL-6 檢測值偏低。讀數前需進行 30 秒震蕩混勻,確保孔內液體濃度均勻,避免因局部濃度差異導致復孔 OD 值波動。酶標儀波長需設置為 450nm,若儀器含 600nm 參考波長,可同時檢測 600nm 波長以扣除背景干擾(如細胞碎片導致的光散射),提升檢測準確性。需注意...
2025-10-01 -
 江蘇化學制藥熱原檢測合規申報
江蘇化學制藥熱原檢測合規申報MAT 法熱原檢測背景值偏高會干擾結果判讀,需從試劑、操作兩方面解決。試劑相關問題中,非特異性活化(如試劑含微量熱原)會導致細胞異常分泌 IL-6,需選用低內毒素的試劑與耗材;檢測試劑添加過多(如抗體濃度過高)會增加非特異性結合,需按說明書稀釋試劑或降低推薦濃度。操作環節問題更多見:孔洗滌不充分會殘留未結合抗體與酶,需按方案完成規定洗滌次數(如 3-5 次),確保洗滌液充分浸潤孔底;洗滌緩沖液污染(如滋生微生物)會引入外源信號,需現配現用緩沖液;加終止液后讀板延遲(超 10 分鐘),會因黃色產物降解導致背景虛高,需加終止液后立即讀板;底物孵育時見光會引發非特異性顯色,需在避光環境下進行 T...
2025-10-01 -
 抗體藥物熱原檢測操作步驟
抗體藥物熱原檢測操作步驟傳統細菌內毒素檢查法(BET)只能檢測革蘭氏陰性菌的 LPS,無法識別革蘭氏陽性菌 LTA、真菌酵母多糖、病毒鞭毛蛋白等非內毒素熱原,存在漏檢風險;同時,部分樣品(如脂質體、表面活性劑制劑)會因內毒素吸附導致低內毒素回收(LER),BET法難以準確定量。MAT 法通過單核細胞表面的多種 TLR 受體(TLR1-TLR10),可識別不同類型熱原:TLR4 識別 LPS、TLR2/TLR6 識別 LTA 與酵母多糖、TLR5 識別鞭毛蛋白、TLR3 識別病毒 dsRNA 等,實現 “全熱原覆蓋”。湖州申科生物熱原檢測試劑盒(MAT法)的驗證數據顯示,其對不同濃度非內毒素熱原均有響應:如 0.1...
2025-10-01 -
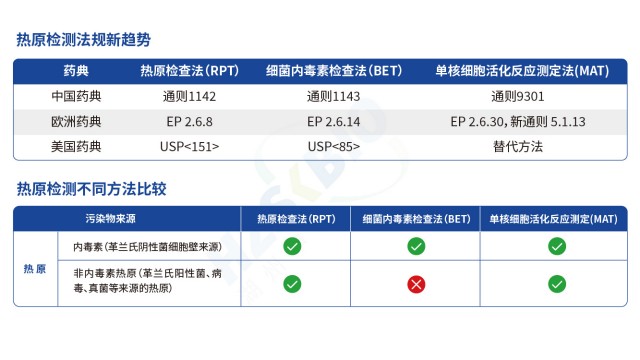
 醫療器械熱原檢測單核細胞活化反應測定法
醫療器械熱原檢測單核細胞活化反應測定法革蘭氏陽性菌注射劑產品只依賴內毒素檢測存在安全風險,需結合熱原檢測特性制定防控方案。內毒素是革蘭氏陰性菌細胞壁的脂多糖成分,而革蘭氏陽性菌可產生非內毒素熱原(NEPs),如脂磷壁酸,這類物質同樣能引發人體發熱反應,若只檢測內毒素,可能遺漏 NEPs 污染,導致臨床用藥風險。對此,風險評估需重點關注三點:一是建議開展家兔法與內毒素檢測的一致性實驗,對比兩種方法的檢測結果,排查是否存在內毒素未檢出但家兔法陽性的情況;二是采用 MAT 法熱原檢測,其通過單核細胞活化機制,可同時識別內毒素與 NEPs,若 MAT 法檢測陽性,需進一步追溯 NEPs 來源;三是若無法排除 NEPs 風險,必須按藥典...
2025-10-01 -
 上海非動物源熱原檢測法規要求
上海非動物源熱原檢測法規要求MAT法(單核細胞活化反應測定)熱原檢測基于人體免疫反應機制設計,原理是:內毒素(革蘭氏陰性菌來源)與非內毒素熱原(革蘭氏陽性菌、霉菌、病毒等來源)進入人體后,會活化單核細胞或單核細胞系,使其釋放 IL-6、IL-1、IL-1β、TNF-α 等促炎細胞因子。檢測時將供試品與單核細胞 / 單核細胞系共孵育,再通過 ELISA 定量檢測釋放的 IL-6 含量,結合內毒素標準品繪制的標曲,即可判斷供試品中熱原含量是否符合規定,實現內毒素與非內毒素熱原的全覆蓋檢測。 歐洲藥典通則 2.6.30 明確 MAT 可替代家兔法熱原檢查,能同時檢測內毒素與非內毒素熱原。上海非動物源熱原檢測法規要求 熱原...
2025-10-01 -
 熱原檢測單核細胞活化反應測定法
熱原檢測單核細胞活化反應測定法單核細胞系培養的高度可控性,為熱原檢測結果的可靠性提供關鍵保障。其培養基配方(如營養成分、血清濃度)可定制,確保細胞獲取充足營養;培養環境(37℃、5% CO?、濕度≥90%)可恒定控制,維持細胞好的活性與 TLR 受體表達水平,避免因環境波動導致細胞功能異常。這種可控性還能防止細胞遺傳突變與外源污染(如支原體、病毒),確保不同批次單核細胞系的熱原響應一致性,讓熱原檢測結果批間差異小,符合 GMP 對檢測方法穩定性的要求。 保持細胞活性穩定,是實現準確熱原檢測的基礎條件。熱原檢測單核細胞活化反應測定法 MAT法(單核細胞活化反應測定)熱原檢測基于人體免疫反應機制設計,原理是:內毒素(革蘭...
2025-10-01 -
 江蘇血液制品熱原檢測歐盟出口方案
江蘇血液制品熱原檢測歐盟出口方案相較于傳統家兔法,熱原檢測MAT法在動物福利、檢測性能、適用范圍等方面具有明顯優勢。從動物福利看,MAT法使用分離培養的單核細胞系(如湖州申科 HL-60 細胞系),無需動物,完全符合 “減少、替代、優化” 的 3R 原則,規避家兔法的倫理爭議與飼養成本。檢測性能上,家兔法只能定性且靈敏度低(檢測限≥5EU/kg),結果受動物個體差異、環境溫度影響大;MAT 法可定量檢測,標曲線性范圍 0.0125-1.0EU/mL,檢測限(LOD)達 0.0125EU/mL,批間 CV≤25%,重復性更優。適用范圍方面,家兔法不適用于放射性質藥物、基因療法制劑等可能影響動物體溫的產品;MAT法適配疫苗、...
2025-10-01 -
 浙江重組蛋白熱原檢測
浙江重組蛋白熱原檢測熱原是指微量即可引發恒溫動物體溫異常升高的物質,分為內源性(如細胞因子)與外源性兩類,外源性熱原又涵蓋微生物來源(革蘭氏陰性菌脂多糖 LPS、革蘭氏陽性菌脂磷壁酸 LTA、病毒、真菌等)與非微生物來源(灰塵、橡膠降解產物等)。傳統細菌內毒素檢查法(BET)只能檢測革蘭氏陰性菌的 LPS,無法覆蓋非內毒素熱原,而單核細胞活化試驗(MAT)可彌補這一缺陷。其原理是:熱原通過活化單核細胞表面的 Toll 樣受體(TLR,如 TLR4 識別 LPS、TLR2/TLR6 識別 LTA),啟動先天免疫反應,促使細胞釋放 IL-6、TNF-α 等促炎細胞因子;隨后采用 ELISA 法檢測 IL-6 濃度...
2025-10-01 -
 北京重組蛋白熱原檢測歐盟出口方案
北京重組蛋白熱原檢測歐盟出口方案在 MAT 熱原檢測中,單核細胞系與 PBMC(外周血單個核細胞)的檢測結果穩定性差異明顯。實驗結果數據顯示,單核細胞系的標曲 R2 達 1.000,各濃度點 CV 值極低(如 ST1 為 0.92%、ST2 為 1.5%),相對偏差均在 5% 以內;而 PBMC 的標曲 R2 為 0.997,部分濃度點 CV 值超 20%(如 ST2 為 39.6%、ST6 為 45.5%),相對偏差高達 171.43%。這種差異源于兩者對熱原反應的一致性—單核細胞系能穩定釋放 IL-6,PBMC 則因供體差異導致 IL-6 釋放水平波動,直接影響熱原檢測結果的重復性,單核細胞系更適配準確的熱原定量需求...
2025-10-01 -
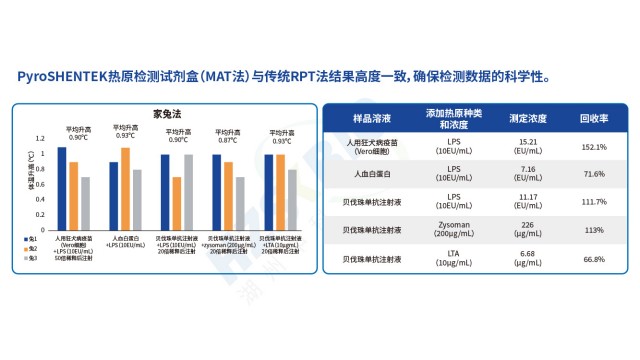
 血液制品熱原檢測MAT法
血液制品熱原檢測MAT法PyroSHENTEK?熱原檢測試劑盒突破傳統檢測方法局限,不僅能檢測革蘭氏陰性菌來源的內毒素,還可準確識別革蘭氏陽性菌(脂磷壁酸 LTA)、病毒、真菌等產生的非內毒素熱原(NEP),契合熱原檢測 “全風險覆蓋” 的法規需求。其定量限低至 0.025EU/mL,實驗數據顯示,對 Flagellin、LTA、Resiquimod、Poly-IC 等多種 NEP 均能有效檢出,且加標回收率穩定在 50%-200% 合格范圍(如貝伐珠單抗注射液中 LTA 加標回收率 66.8%、Zysoman 加標回收率 113%)。此外,試劑盒聯合了國內相關機構完成室間驗證,與傳統家兔熱原試驗(RPT)橋接結...
2025-09-30 -
 北京原料藥熱原檢測商業化試劑盒
北京原料藥熱原檢測商業化試劑盒湖州申科生物熱原檢測(MAT法) 試劑盒在靈敏度、穩定性與適用性上表現突出,關鍵性能參數符合藥典要求:標曲線性范圍 0.0125-1.0EU/mL,相關系數 R2≥0.98,定量限 0.025EU/mL,檢測限(LOD)0.0125EU/mL,批間精密度 CV≤25%,可準確捕捉微量熱原。其優勢在于特定的單核細胞系 —— 與依賴供體血液的 PBMC 細胞不同,申科 MAT 細胞系來源清晰可溯源,無需倫理審批與血站合作,規避供體差異導致的檢測波動。對比同類型產品(如國外廠家 PBMC 細胞),申科細胞系的標曲各濃度點 CV 更低( 低至3.6%)、相對偏差更小( 12.31%),線性 R2 ...
2025-09-30 -
 北京抗體藥物熱原檢測常見問題分析
北京抗體藥物熱原檢測常見問題分析MAT 試劑盒配套的即用型細胞存在明確的傳代限制,且商業化傳代需獲得授權,關鍵是保障細胞質量與檢測可靠性。首先,即用型細胞經特殊工藝優化,已處于較好的活性與熱原響應狀態,不適合傳代,傳代后細胞會出現 TLR 受體表達下降、炎癥因子分泌減少等問題,導致熱原檢測靈敏度降低,如 HL-60 細胞傳代超過 5 代后,IL-6 分泌量下降 30%,無法滿足檢測要求。其次,若用戶需將即用型細胞用于商業化生產(如大規模檢測),需獲得湖州申科授權,包括用戶資質審核、技術培訓、傳代方案驗證,確保用戶具備細胞培養與質量控制能力,避免未經授權傳代導致細胞特性改變,影響檢測結果一致性。此外,參考文獻數據,即使是可...
2025-09-30 -
 湖北合規性熱原檢測
湖北合規性熱原檢測單核細胞系培養的高度可控性,為熱原檢測結果的可靠性提供關鍵保障。其培養基配方(如營養成分、血清濃度)可定制,確保細胞獲取充足營養;培養環境(37℃、5% CO?、濕度≥90%)可恒定控制,維持細胞好的活性與 TLR 受體表達水平,避免因環境波動導致細胞功能異常。這種可控性還能防止細胞遺傳突變與外源污染(如支原體、病毒),確保不同批次單核細胞系的熱原響應一致性,讓熱原檢測結果批間差異小,符合 GMP 對檢測方法穩定性的要求。 湖州申科熱原檢測試劑盒(MAT)的單核細胞系無供體依賴性,解決PBMC因免疫狀態差異的結果波動。湖北合規性熱原檢測 相較于傳統家兔法,熱原檢測MAT法在動物福利、檢測...
2025-09-30 -
 上海原料藥熱原檢測商業化試劑盒
上海原料藥熱原檢測商業化試劑盒MAT法熱原檢測中,樣品與細胞共培養時長需嚴格控制,以保障炎癥因子分泌量穩定。說明書要求共培養 24 小時,雖未明確允差,但實驗驗證顯示,±30 分鐘的允差對結果無明顯影響 —— 細胞因子(如 IL-6)分泌具有時間依賴性,24 小時左右達到分泌平臺期,半小時差異不會導致分泌量大幅波動。若實驗室對結果穩定性要求極高(如 QC 放行檢測),建議嚴格按 24 小時操作,避免因時長差異引入誤差;若為預實驗(如樣品稀釋倍數摸索),±30 分鐘允差可接受,但需在記錄中注明實際培養時長。需注意的是,共培養時長不可超過 26 小時或短于 22 小時:過長會導致細胞活性下降(炎癥因子分泌減少),過短則未達...
2025-09-30