-
 生物制品熱原檢測技術服務
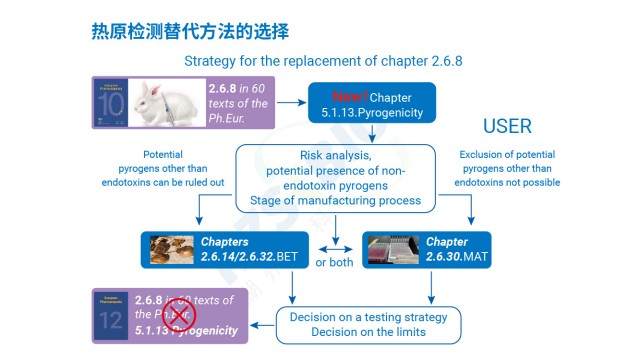
生物制品熱原檢測技術服務革蘭氏陽性菌注射劑產品只依賴內毒素檢測存在安全風險,需結合熱原檢測特性制定防控方案。內毒素是革蘭氏陰性菌細胞壁的脂多糖成分,而革蘭氏陽性菌可產生非內毒素熱原(NEPs),如脂磷壁酸,這類物質同樣能引發人體發熱反應,若只檢測內毒素,可能遺漏 NEPs 污染,導致臨床用藥風險。對此,風險評估需重點關注三點:一是建議開展家兔法與內毒素檢測的一致性實驗,對比兩種方法的檢測結果,排查是否存在內毒素未檢出但家兔法陽性的情況;二是采用 MAT 法熱原檢測,其通過單核細胞活化機制,可同時識別內毒素與 NEPs,若 MAT 法檢測陽性,需進一步追溯 NEPs 來源;三是若無法排除 NEPs 風險,必須按藥典...
2025-10-10 -
 上海非動物源熱原檢測歐盟出口方案
上海非動物源熱原檢測歐盟出口方案MAT法熱原檢測中,ELISA 加終止液后的讀數時間需嚴格控制,以保障 IL-6 檢測信號穩定。湖州申科生物MAT試劑盒說明書明確要求,終止液添加后需在 10 分鐘內完成讀數,且需避光操作 —— 原因在于,終止液(如硫酸)會終止 TMB 顯色反應,但生成的黃色產物在光照下易降解,超過 10 分鐘后 OD 值會下降,導致 IL-6 檢測值偏低。讀數前需進行 30 秒震蕩混勻,確保孔內液體濃度均勻,避免因局部濃度差異導致復孔 OD 值波動。酶標儀波長需設置為 450nm,若儀器含 600nm 參考波長,可同時檢測 600nm 波長以扣除背景干擾(如細胞碎片導致的光散射),提升檢測準確性。需注意...
2025-10-10 -
 上海生物制品熱原檢測規范
上海生物制品熱原檢測規范MAT 法熱原檢測的關鍵機制是 “熱原活化單核細胞 TLR 受體,觸發炎癥因子分泌”,TLR 受體的全覆蓋是保障檢測無遺漏的關鍵。不同熱原需活化不同 TLR 受體:最常見的內毒素(LPS)主要活化 TLR4,而革蘭氏陽性菌的非內毒素熱原(如脂磷壁酸)需活化 TLR2/6,真菌多糖活化?TLR2/4,病毒核酸活化 TLR3/7/8 等。因此,MAT 試劑盒配套細胞需具備全覆蓋的 TLR 受體表達—湖州申科生物通過 Western blot 驗證,其 HL-60 細胞系表達 TLR1-TLR9,可響應各類熱原。為進一步驗證覆蓋能力,申科用不同非內毒素熱原配體(如脂磷壁酸、酵母多糖)刺激細胞,結...
2025-10-10 -
 安徽熱原檢測合規申報
安徽熱原檢測合規申報熱原檢測MAT法的法規地位持續提升,已成為多國藥典認可的熱原檢測替代方法。歐洲藥典(EP)是推動 MAT 應用的關鍵力量:通則 2.6.30 明確 MAT 可替代家兔熱原試驗(RPT),且能同時檢測內毒素與非內毒素熱原;2024 年歐洲藥典委員會批準刪除所有條款中的家兔法,修訂文本將于 2025 年7月1日生效,強制鼓勵使用 MAT 等體外替代方法。美國藥典(USP)<151> 規定,經驗證的體外熱原試驗(如 MAT)可替代家兔法,且需依據 USP<1225>開展驗證;FDA 行業指南進一步明確 MAT 的合規性。中國藥典 2020 年版通則 9301 將 MAT 列為熱原檢查的補充方法,...
2025-10-10 -
 上海非動物源熱原檢測技術服務
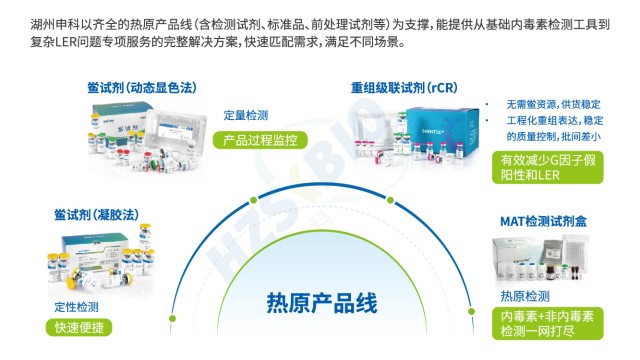
上海非動物源熱原檢測技術服務熱原是能引發恒溫動物體溫異常升高的物質總稱,主要成分為細菌內毒素(革蘭氏陰性菌脂多糖 LPS),同時涵蓋病毒、真菌毒素、支原體等非內毒素熱原,其檢測是保障藥品與醫療器械安全性的關鍵環節。當前熱原檢測已形成 “特異性檢測 + 廣譜篩查” 互補的完整體系:以鱟試驗法(含天然 LAL 與重組 rCR/rFC 試劑)作為細菌內毒素的特異性檢測手段,憑借 fg 級靈敏度成為制藥行業常規質控方法,可通過凝膠法實現定性、動態濁度 / 顯色法完成定量;以家兔熱原試驗作為傳統廣譜篩查方法,雖操作繁瑣(需預試篩選基礎體溫穩定家兔,正式試驗觀察 3 小時體溫變化),但仍是放射性質的藥物、血液制品等高風險產品排除...
2025-10-10 -
 北京高效熱原檢測技術服務
北京高效熱原檢測技術服務熱原檢測技術自 20 世紀初問世以來,經歷了 “動物試驗→體外生化檢測→細胞生物學檢測” 的三次關鍵變革,每一次變革均推動檢測效率、準確性與全面性的提升。20 世紀初至中期,熱原檢測方法只有家兔熱原試驗,通過觀察家兔體溫變化篩查熱原,雖實現了廣譜檢測,但存在動物成本高、操作繁瑣、靈敏度低、種屬差異大等局限,難以滿足制藥行業快速發展需求。20 世紀 60 年代,鱟試驗法(LAL 法)的發明開啟了熱原檢測的 “體外生化時代”,利用鱟血變形細胞裂解物的凝血級聯反應檢測細菌內毒素,靈敏度提升至 ng 級,檢測時間縮短至 1-2 小時,迅速成為制藥行業常規質控方法;但該方法依賴鱟資源,易受 β- 葡...
2025-10-10 -
 上海血液制品熱原檢測法規要求
上海血液制品熱原檢測法規要求熱原是指微量即可引發恒溫動物體溫異常升高的物質,分為內源性(如細胞因子)與外源性兩類,外源性熱原又涵蓋微生物來源(革蘭氏陰性菌脂多糖 LPS、革蘭氏陽性菌脂磷壁酸 LTA、病毒、真菌等)與非微生物來源(灰塵、橡膠降解產物等)。傳統細菌內毒素檢查法(BET)只能檢測革蘭氏陰性菌的 LPS,無法覆蓋非內毒素熱原,而單核細胞活化試驗(MAT)可彌補這一缺陷。其原理是:熱原通過活化單核細胞表面的 Toll 樣受體(TLR,如 TLR4 識別 LPS、TLR2/TLR6 識別 LTA),啟動先天免疫反應,促使細胞釋放 IL-6、TNF-α 等促炎細胞因子;隨后采用 ELISA 法檢測 IL-6 濃度...
2025-10-10 -
 上海血液制品熱原檢測操作步驟
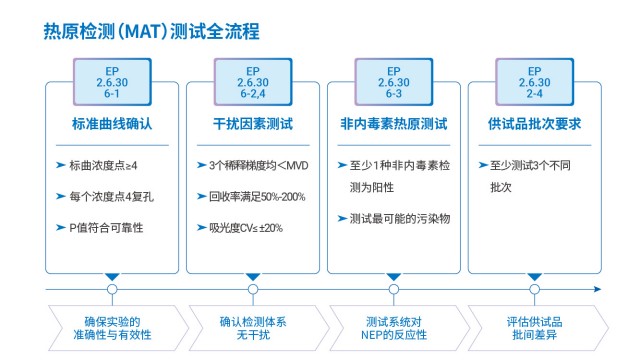
上海血液制品熱原檢測操作步驟含消除炎癥成分的樣品可能抑制 IL-6 產生,需通過科學評估排除干擾,確保 MAT 法熱原檢測結果準確。根據藥典要求,若樣品能抑制單核細胞促炎癥因子釋放,需通過以下步驟驗證適用性:首先,選擇樣品 A、2A、4A 倍稀釋(均不超過上限有效稀釋倍數 MVD),避免高濃度消除炎癥成分過度抑制;其次,進行供試品加標回收率實驗,若回收率在 50%-200% 的合格范圍,說明消除炎癥成分未影響熱原檢測;再對比 “供試品配制的標曲” 與 “稀釋液配制的標曲”,若兩者 IL-6 檢測值相差在 ±20% 以內,表明樣品基質對檢測無系統性干擾。例如,某消除炎癥單抗樣品經 2 倍稀釋后,加標回收率達 120%,...
2025-10-10 -
 北京疫苗熱原檢測體系
北京疫苗熱原檢測體系MAT 法熱原檢測的關鍵機制是 “熱原活化單核細胞 TLR 受體,觸發炎癥因子分泌”,TLR 受體的全覆蓋是保障檢測無遺漏的關鍵。不同熱原需活化不同 TLR 受體:最常見的內毒素(LPS)主要活化 TLR4,而革蘭氏陽性菌的非內毒素熱原(如脂磷壁酸)需活化 TLR2/6,真菌多糖活化?TLR2/4,病毒核酸活化 TLR3/7/8 等。因此,MAT 試劑盒配套細胞需具備全覆蓋的 TLR 受體表達—湖州申科生物通過 Western blot 驗證,其 HL-60 細胞系表達 TLR1-TLR9,可響應各類熱原。為進一步驗證覆蓋能力,申科用不同非內毒素熱原配體(如脂磷壁酸、酵母多糖)刺激細胞,結...
2025-10-10 -
 遼寧熱原檢測技術服務
遼寧熱原檢測技術服務MAT 試劑盒配套的即用型細胞存在明確的傳代限制,且商業化傳代需獲得授權,關鍵是保障細胞質量與檢測可靠性。首先,即用型細胞經特殊工藝優化,已處于較好的活性與熱原響應狀態,不適合傳代,傳代后細胞會出現 TLR 受體表達下降、炎癥因子分泌減少等問題,導致熱原檢測靈敏度降低,如 HL-60 細胞傳代超過 5 代后,IL-6 分泌量下降 30%,無法滿足檢測要求。其次,若用戶需將即用型細胞用于商業化生產(如大規模檢測),需獲得湖州申科授權,包括用戶資質審核、技術培訓、傳代方案驗證,確保用戶具備細胞培養與質量控制能力,避免未經授權傳代導致細胞特性改變,影響檢測結果一致性。此外,參考文獻數據,即使是可...
2025-10-10 -
 疫苗熱原檢測
疫苗熱原檢測湖州申科生物熱原檢測試劑盒(MAT 法,貨號 1502100)包含完整的檢測體系,組分按功能可分為細胞培養類、ELISA 檢測類與輔助類,且儲存條件明確。細胞培養類組分包括:2-8℃儲存的培養液(25mL×2 瓶)、96 孔細胞孵育板,-18℃儲存的培養液添加劑(1.5mL×1 管)、細菌內毒素工作標準品,以及需液氮保存的 MAT 細胞(2 支),確保細胞活性與穩定性。ELISA 檢測類組分涵蓋:2-8℃儲存的生物素偶聯抗 IL-6 抗體(200×,60μL)、鏈霉親和素 HRP 復合物(100×,140μL)、TMB 顯色液(12mL)、終止液(6mL),以及抗 IL-6 預包被酶標板(...
2025-10-10 -
 上海熱原檢測常見問題分析
上海熱原檢測常見問題分析在 MAT 法熱原檢測中,PBMC(外周血單核細胞)與單核細胞系各有優劣,單核細胞系更適合標準化檢測。PBMC 的優勢在于免疫細胞成分豐富(含單核細胞、淋巴細胞等),對熱原反應敏感,靈敏度相對較高;但局限同樣明顯 ——PBMC 需從不同供體獲取,供體免疫狀態差異會導致檢測結果不穩定,且無法長期保存,難以建立標準化方法學。單核細胞系(如 HL-60、MM6、THP1)則克服了 PBMC 的局限:細胞來源穩定(可批量培養),TLR 受體表達覆蓋主要亞型(如 HL-60 表達 TLR1-TLR9),對熱原反應重復性好,更適合商業化試劑盒與法規檢測。不同單核細胞系性能也有差異:MM6/IL-6 法...
2025-10-10 -
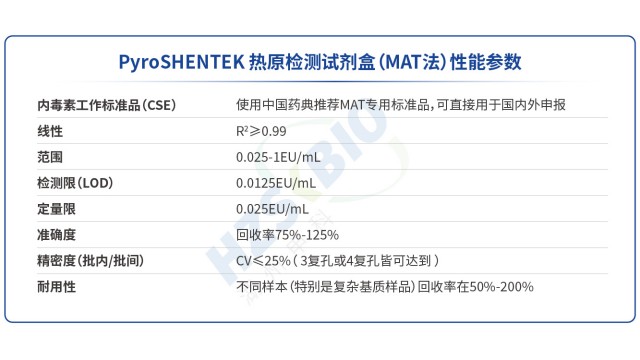 江蘇高效熱原檢測法規要求
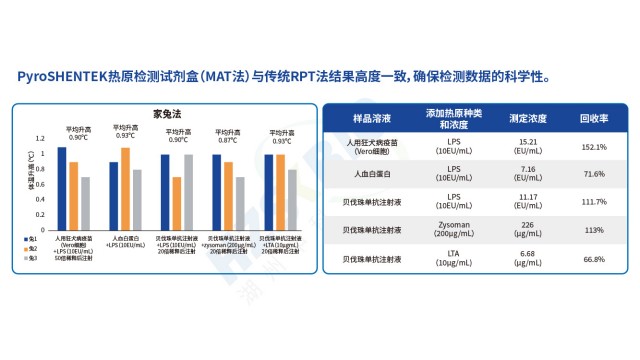
江蘇高效熱原檢測法規要求PyroSHENTEK?熱原檢測試劑盒突破傳統檢測方法局限,不僅能檢測革蘭氏陰性菌來源的內毒素,還可準確識別革蘭氏陽性菌(脂磷壁酸 LTA)、病毒、真菌等產生的非內毒素熱原(NEP),契合熱原檢測 “全風險覆蓋” 的法規需求。其定量限低至 0.025EU/mL,實驗數據顯示,對 Flagellin、LTA、Resiquimod、Poly-IC 等多種 NEP 均能有效檢出,且加標回收率穩定在 50%-200% 合格范圍(如貝伐珠單抗注射液中 LTA 加標回收率 66.8%、Zysoman 加標回收率 113%)。此外,試劑盒聯合了國內相關機構完成室間驗證,與傳統家兔熱原試驗(RPT)橋接結...
2025-10-09 -
 重慶熱原檢測技術服務
重慶熱原檢測技術服務MAT法熱原檢測中,樣品與細胞共培養時長需嚴格控制,以保障炎癥因子分泌量穩定。說明書要求共培養 24 小時,雖未明確允差,但實驗驗證顯示,±30 分鐘的允差對結果無明顯影響 —— 細胞因子(如 IL-6)分泌具有時間依賴性,24 小時左右達到分泌平臺期,半小時差異不會導致分泌量大幅波動。若實驗室對結果穩定性要求極高(如 QC 放行檢測),建議嚴格按 24 小時操作,避免因時長差異引入誤差;若為預實驗(如樣品稀釋倍數摸索),±30 分鐘允差可接受,但需在記錄中注明實際培養時長。需注意的是,共培養時長不可超過 26 小時或短于 22 小時:過長會導致細胞活性下降(炎癥因子分泌減少),過短則未達...
2025-10-09 -
 上海抗體藥物熱原檢測合規申報
上海抗體藥物熱原檢測合規申報MAT 法熱原檢測中,細胞傳代的代次控制是保障檢測穩定性的關鍵,需結合細胞特性與文獻數據制定標準。參考行業文獻,單核細胞系(如 HL-60、THP1)的使用代次通常不超過 20 代,代次過高會導致細胞生物學特性改變:一是 TLR 受體表達下降,如 TLR4 表達量在 20 代后下降 40%,導致內毒素檢測靈敏度降低;二是細胞倍增時間延長,從 24 小時延長至 36 小時,影響共培養時長的準確性;三是炎癥因子分泌減少,IL-6 分泌量在 20 代后下降 35%,導致熱原濃度低估。申科對配套的 HL-60 細胞系進行代次穩定性驗證,結果顯示:1-15 代細胞的熱原響應性一致(加標回收率 85%...
2025-10-09 -
 抗體藥物熱原檢測法規要求
抗體藥物熱原檢測法規要求MAT法熱原檢測中,ELISA 加終止液后的讀數時間需嚴格控制,以保障 IL-6 檢測信號穩定。湖州申科生物MAT試劑盒說明書明確要求,終止液添加后需在 10 分鐘內完成讀數,且需避光操作 —— 原因在于,終止液(如硫酸)會終止 TMB 顯色反應,但生成的黃色產物在光照下易降解,超過 10 分鐘后 OD 值會下降,導致 IL-6 檢測值偏低。讀數前需進行 30 秒震蕩混勻,確保孔內液體濃度均勻,避免因局部濃度差異導致復孔 OD 值波動。酶標儀波長需設置為 450nm,若儀器含 600nm 參考波長,可同時檢測 600nm 波長以扣除背景干擾(如細胞碎片導致的光散射),提升檢測準確性。需注意...
2025-10-09 -
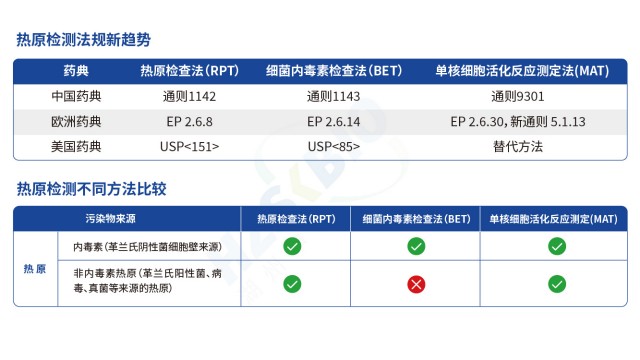 湖南合規性熱原檢測
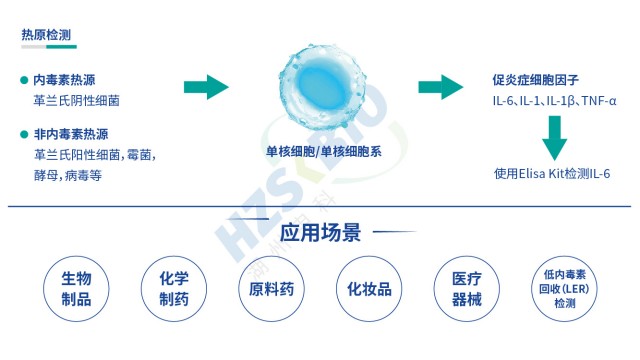
湖南合規性熱原檢測MAT法(單核細胞活化反應測定)熱原檢測基于人體免疫反應機制設計,原理是:內毒素(革蘭氏陰性菌來源)與非內毒素熱原(革蘭氏陽性菌、霉菌、病毒等來源)進入人體后,會活化單核細胞或單核細胞系,使其釋放 IL-6、IL-1、IL-1β、TNF-α 等促炎細胞因子。檢測時將供試品與單核細胞 / 單核細胞系共孵育,再通過 ELISA 定量檢測釋放的 IL-6 含量,結合內毒素標準品繪制的標曲,即可判斷供試品中熱原含量是否符合規定,實現內毒素與非內毒素熱原的全覆蓋檢測。 MAT 熱原檢測中細胞活性影響巨大,活率需達一定標準保證檢測效果。湖南合規性熱原檢測 MAT 法熱原檢測的關鍵機制是 “熱原活化單...
2025-10-09 -
 疫苗熱原檢測流程
疫苗熱原檢測流程MAT法熱原檢測中,非內毒素熱原(NEP)對照品設為 “選做”,且試劑盒不默認配備,需結合檢測需求靈活使用,背后有明確的設置邏輯。首先,試劑盒開發階段已通過驗證(用多種 NEP 配體刺激細胞),證明其可檢出 NEP,后期實驗是否加入 NEP 對照,只需根據內部管理要求或專業人員建議確定,無需強制設置;若產品產線明確無 NEP 污染風險(如只使用革蘭氏陰性菌原料),可刪除 NEP 對照,簡化操作。其次,試劑盒不配備 NEP 對照品,是因不同用戶需求差異大 —— 部分用戶需檢測特定 NEP(如脂磷壁酸),部分需檢測廣譜 NEP,因此提供單獨購買選項,用戶可按需選擇,避免資源浪費。NEP 對照品...
2025-10-09 -
 四川熱原檢測規范
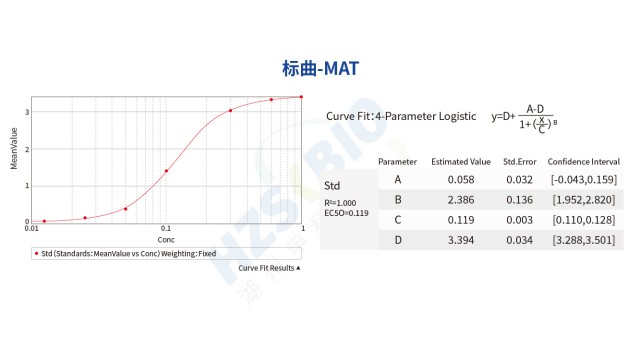
四川熱原檢測規范MAT 法熱原檢測標曲采用非倍比稀釋,而非 1-0.5-0.25 的倍比稀釋,主要優勢在于提升標曲準確性與適用性,避免稀釋誤差影響。一是可密集覆蓋關鍵濃度區間:熱原檢測的重點關注區為低濃度拐點(如 0.0125-0.1EU/mL)與高濃度平臺區(如 0.5-1EU/mL),非倍比稀釋可在這些區間設置更多濃度點(如 0.0125、0.025、0.05、0.1、0.25、0.5、1EU/mL),提升曲線擬合精度,而倍比稀釋低濃度點少,易導致低濃度熱原定量不準。二是降低稀釋誤差累積:倍比稀釋需連續稀釋(如 1EU/mL→0.5EU/mL→0.25EU/mL),每一步誤差會累積,導致低濃度點實際濃...
2025-10-09 -
 上海醫療器械熱原檢測風險評估
上海醫療器械熱原檢測風險評估熱原是指微量即可引發恒溫動物體溫異常升高的物質,分為內源性(如細胞因子)與外源性兩類,外源性熱原又涵蓋微生物來源(革蘭氏陰性菌脂多糖 LPS、革蘭氏陽性菌脂磷壁酸 LTA、病毒、真菌等)與非微生物來源(灰塵、橡膠降解產物等)。傳統細菌內毒素檢查法(BET)只能檢測革蘭氏陰性菌的 LPS,無法覆蓋非內毒素熱原,而單核細胞活化試驗(MAT)可彌補這一缺陷。其原理是:熱原通過活化單核細胞表面的 Toll 樣受體(TLR,如 TLR4 識別 LPS、TLR2/TLR6 識別 LTA),啟動先天免疫反應,促使細胞釋放 IL-6、TNF-α 等促炎細胞因子;隨后采用 ELISA 法檢測 IL-6 濃度...
2025-10-09 -
 北京抗體藥物熱原檢測MAT法
北京抗體藥物熱原檢測MAT法PBMC(外周血單個核細胞)用于 MAT 熱原檢測時,存在異質性與血源供應兩大關鍵問題。從異質性來看,PBMC 含 12% 單核細胞與 88% 淋巴細胞,且來自不同供體,細胞組成、功能狀態及熱原反應存在明顯差異,導致熱原刺激后 IL-6 釋放量波動大,標準化難度高。血源供應方面,除受獻血者數量、時間及采集血液政策限制外,EP2.6.30 還要求嚴格檢測乙肝、丙肝等標志物,且采集血液、處理、試劑制備全程需無菌操作,流程環節多、復雜度高,遠不及單核細胞系制備簡便,易影響熱原檢測的時效性與穩定性。家兔法是熱原檢測 “金標準”,但操作繁瑣、耗時且需動物設施,存在明顯局限。北京抗體藥物熱原檢測MAT法 ...
2025-10-09 -
 黑龍江熱原檢測家兔法替代方案
黑龍江熱原檢測家兔法替代方案MAT 試劑盒熱原檢測配套細胞的質量控制,是保障檢測結果可靠的重要環節,需從功能、安全性、穩定性三方面建立體系。在功能鑒定上,按歐洲 MAT 法要求,需檢測細胞的 Toll 樣受體(TLR1-TLR9)表達情況—確保細胞能響應不同類型熱原(如 TLR4 響應 LPS、TLR2/6 響應脂磷壁酸);同時考察細胞倍增時間(確保活性穩定)、熱原反應性(對標準內毒素和非內毒素熱原的信號強度),確保細胞具備熱原識別與炎癥因子分泌能力。在安全性檢測上,需驗證細胞無菌(無細菌、真菌污染)、無支原體、無外源病毒因子(如 HIV、HBV)及分枝桿菌,避免外源污染影響檢測結果。在穩定性考察上,需監測不同代次細...
2025-10-08 -
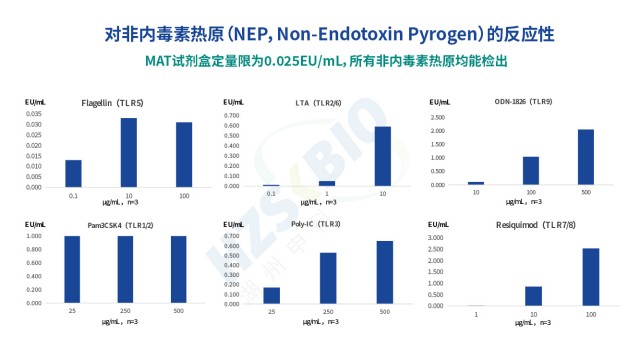 北京重組蛋白熱原檢測單核細胞活化反應測定法
北京重組蛋白熱原檢測單核細胞活化反應測定法MAT法熱原檢測特定標準品與傳統細菌內毒素國家標準品存在本質差異,需明確區分以保障檢測準確性。MAT 特定標準品為大腸桿菌(E.coli 0113:H10:K)菌株制備,經全國 5 家藥品檢驗所(含中檢院)用凝膠法、動態濁度法及動態顯色法協作標定,溯源至國際標準品,可同時檢測內毒素與非內毒素熱原;而傳統細菌內毒素國家標準品(如 9000EU 規格)源自大腸桿菌(E.coli O111:B4),只適用于內毒素檢測,無法識別非內毒素熱原。關鍵驗證數據顯示,用 MAT法檢測 9000EU 內毒素標準品時,加標回收率不在 50%-200% 的合格范圍,因此不能替代 MAT 特定標準品。值得注意的是...
2025-10-08 -
 生物制品熱原檢測結果判定
生物制品熱原檢測結果判定PBMC(外周血單個核細胞)的供體差異會直接導致熱原檢測結果的波動,主要體現在 IL-6 釋放水平的不一致。不同供體的 PBMC,其單核細胞比例、TLR 受體表達量、免疫活性狀態存在差異:有的供體 PBMC 受熱原刺激后, IL-6 釋放量高;有的則極低,甚至無明顯響應。實驗數據顯示, PBMC 的標曲各濃度點相對偏差有高達 171.43%的,正是這種差異的體現,導致熱原檢測結果難以標準化,無法準確判斷供試品熱原是否超標,從而增加了藥品的質量控制風險。 湖州申科熱原檢測試劑盒聯合了國內相關機構室間驗證,與傳統RPT法結果高度一致,符合法規要求。生物制品熱原檢測結果判定 熱原是能引發恒溫動...
2025-10-08 -
 福建生物制品熱原檢測
福建生物制品熱原檢測MAT 法熱原檢測背景值偏高會干擾結果判讀,需從試劑、操作兩方面解決。試劑相關問題中,非特異性活化(如試劑含微量熱原)會導致細胞異常分泌 IL-6,需選用低內毒素的試劑與耗材;檢測試劑添加過多(如抗體濃度過高)會增加非特異性結合,需按說明書稀釋試劑或降低推薦濃度。操作環節問題更多見:孔洗滌不充分會殘留未結合抗體與酶,需按方案完成規定洗滌次數(如 3-5 次),確保洗滌液充分浸潤孔底;洗滌緩沖液污染(如滋生微生物)會引入外源信號,需現配現用緩沖液;加終止液后讀板延遲(超 10 分鐘),會因黃色產物降解導致背景虛高,需加終止液后立即讀板;底物孵育時見光會引發非特異性顯色,需在避光環境下進行 T...
2025-10-08 -
 江蘇抗體藥物熱原檢測歐盟出口方案
江蘇抗體藥物熱原檢測歐盟出口方案湖州申科生物熱原檢測(MAT法) 試劑盒在靈敏度、穩定性與適用性上表現突出,關鍵性能參數符合藥典要求:標曲線性范圍 0.0125-1.0EU/mL,相關系數 R2≥0.98,定量限 0.025EU/mL,檢測限(LOD)0.0125EU/mL,批間精密度 CV≤25%,可準確捕捉微量熱原。其優勢在于特定的單核細胞系 —— 與依賴供體血液的 PBMC 細胞不同,申科 MAT 細胞系來源清晰可溯源,無需倫理審批與血站合作,規避供體差異導致的檢測波動。對比同類型產品(如國外廠家 PBMC 細胞),申科細胞系的標曲各濃度點 CV 更低( 低至3.6%)、相對偏差更小( 12.31%),線性 R2 ...
2025-10-08 -
 安徽熱原檢測商業化試劑盒
安徽熱原檢測商業化試劑盒MAT 試劑盒熱原檢測配套細胞的質量控制,是保障檢測結果可靠的重要環節,需從功能、安全性、穩定性三方面建立體系。在功能鑒定上,按歐洲 MAT 法要求,需檢測細胞的 Toll 樣受體(TLR1-TLR9)表達情況—確保細胞能響應不同類型熱原(如 TLR4 響應 LPS、TLR2/6 響應脂磷壁酸);同時考察細胞倍增時間(確保活性穩定)、熱原反應性(對標準內毒素和非內毒素熱原的信號強度),確保細胞具備熱原識別與炎癥因子分泌能力。在安全性檢測上,需驗證細胞無菌(無細菌、真菌污染)、無支原體、無外源病毒因子(如 HIV、HBV)及分枝桿菌,避免外源污染影響檢測結果。在穩定性考察上,需監測不同代次細...
2025-10-08 -
 上海醫療器械熱原檢測家兔法替代方案
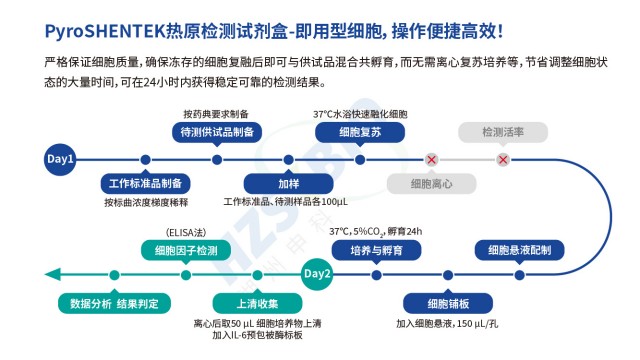
上海醫療器械熱原檢測家兔法替代方案湖州申科生物MAT試劑盒配套的即用型細胞,需嚴格遵循解凍與使用規范,避免細胞活性下降影響熱原檢測結果。首先,解凍操作需快速:從液氮罐或 - 80℃冰箱取出細胞后,立即放入 37℃水浴鍋快速解凍(約 1-2 分鐘),避免緩慢解凍導致細胞內形成冰晶,損傷細胞膜;解凍后需立即取出,用 75% 酒精擦拭管外壁消毒,防止污染。其次,細胞解凍后需一次性使用完畢,不建議按量添加培養基或添加劑后分次使用—即用型細胞經工藝優化,活性與濃度已預調,分次使用會導致細胞狀態不均(如部分細胞活化、部分休眠),影響熱原反應性。使用時需嚴格按說明書操作:將解凍后的細胞直接加入含樣品的微孔板中,無需額外洗滌或稀釋,若樣品...
2025-10-08 -
 上海血液制品熱原檢測合規申報
上海血液制品熱原檢測合規申報單核細胞活化反應測定(MAT)是近年來熱原檢測領域的突破性技術,其原理基于人體免疫系統對熱原的天然應答機制:人源單核細胞(如 THP-1 細胞系或新鮮人全血單核細胞)在熱原刺激下,會活化胞內炎癥信號通路,釋放 IL-6、TNF-α 等促炎細胞因子,通過 ELISA 檢測細胞因子的濃度,即可間接反映樣品中熱原的總量與活性。與傳統檢測方法相比,MAT 法具備三大不可替代的優勢:一是廣譜性,可同時檢測細菌內毒素、病毒、真菌毒素、支原體等所有類型熱原,填補了鱟試驗法只能檢測內毒素的 “非內毒素熱原盲區”,尤其適用于疫苗、基因治療產品等易受多種熱原污染的高風險產品;二是人源相關性,采用與人體同源的細...
2025-10-08 -
 安徽熱原檢測常見問題分析
安徽熱原檢測常見問題分析單核細胞系培養的高度可控性,為熱原檢測結果的可靠性提供關鍵保障。其培養基配方(如營養成分、血清濃度)可定制,確保細胞獲取充足營養;培養環境(37℃、5% CO?、濕度≥90%)可恒定控制,維持細胞好的活性與 TLR 受體表達水平,避免因環境波動導致細胞功能異常。這種可控性還能防止細胞遺傳突變與外源污染(如支原體、病毒),確保不同批次單核細胞系的熱原響應一致性,讓熱原檢測結果批間差異小,符合 GMP 對檢測方法穩定性的要求。 單核細胞活化試驗(MAT)將熱原檢測從經驗性觀察,推進至受體-配體相互作用的分子本質。安徽熱原檢測常見問題分析 MAT法熱原檢測中,樣品與細胞共培養時長需嚴格控制,以...
2025-10-08