-
 北京細胞療法產品支原體檢測試劑盒
北京細胞療法產品支原體檢測試劑盒湖州申科構建了覆蓋全領域、全場景的支原體檢測一站式合規解決方案。產品矩陣豐富,包括支原體 DNA 提取純化試劑盒(2G)、檢測試劑盒(2G,PCR - 熒光探針法)、DNA 校準品、一體化檢測卡盒、外源因子全自動核酸分析系統,以及 10 余種支原體驗證菌株(已上市豬鼻、肺炎、口腔支原體等,即將上市發酵、精氨酸支原體等)。方案具備極強的場景適配性,可應對 5% 人白、高濃度細胞等復雜基質樣品,支持從起始材料到終產品的全流程檢測,滿足細胞療法、抗體、疫苗、CRO/CDMO 等不同領域的檢測需求。服務層面,提供從方法學建立、樣品檢測、適用性驗證、傳統法與 qPCR 法比對到特殊菌株定制的全流程技...
2025-12-04 -
 遼寧重組藥物支原體檢測試劑盒
遼寧重組藥物支原體檢測試劑盒針對不同類型的樣品基質,需采用定制化的支原體檢測前處理方案,以消除干擾、提升檢測效果。細胞懸液需經熱處理、樣品處理液作用、細胞碎片去除、濃縮離心,再 55℃消化;上清或高濃度質粒樣品需先濃縮離心,再用樣品處理液作用后 55℃消化;5% 人血白蛋白樣品則采用濃縮離心 + 樣品處理液作用 + 25℃消化的流程。常見干擾基質包括凍存保護劑、高濃度細胞、代謝產物等,優化前處理可遵循三大原則:提取前通過離心取上清或去除抑制劑預處理樣品;高濃度蛋白樣本提取時增加蛋白酶 K 用量,增強蛋白降解效果;細胞類樣品適當降低細胞數或先裂解細胞,減少細胞基質對檢測的干擾。 全血基質中100 CFU/mL支原體,湖...
2025-12-03 -
 河北重組藥物支原體檢測核酸擴增法
河北重組藥物支原體檢測核酸擴增法質控結果是支原體 NAT 檢測可靠性的前提,需嚴格遵循判定標準,且需結合實驗室實際條件驗證適配的標準閾值。質控樣品的判定規則明確:NTC(無模板對照)的 FAM 信號需 2 復孔 Ct≥40 或無明顯擴增曲線,VIC 信號需 2 復孔 Ct<35 且呈有效 “S” 型擴增;NCS(陰性對照)判定標準與 NTC 一致;PC(陽性質控)的 FAM 信號需 2 復孔 Ct<35 且呈有效 “S” 型擴增,PCS(陽性對照底物)判定標準與 PC 一致。只有質控結果全部滿足要求,才能進一步分析樣本結果,若質控不達標,需排查設備、試劑、操作等環節的問題并重新檢測。 支原體檢測需驗證專屬性,避免與革蘭氏...
2025-12-03 -
 陜西支原體檢測
陜西支原體檢測湖州申科圍繞 USP 支原體培養法,提供技術服務,滿足生物制劑企業的合規需求。服務內容包括兩項:一是支原體培養法樣品檢測服務,嚴格遵循 USP 63 標準流程執行,確保檢測結果合規有效;二是支原體培養法樣品適用性驗證服務,針對供試品特性開展定制化驗證,保障檢測方法與樣品的適配性。所有檢測與驗證完成后,公司將出具標準化報告,報告可直接用于項目申報、審批、工藝優化等場景,為企業產品質量控制提供依據。通過專業的技術服務,幫助企業規避合規風險,確保生物制劑生產全流程的質量與安全性,助力企業高效推進產品研發與上市進程。 湖州申科支原體驗證菌株溯源至 ATCC/CVCC,標定 10CFU/100CFU...
2025-12-03 -
 遼寧生物制品支原體檢測技術服務
遼寧生物制品支原體檢測技術服務質控結果是支原體 NAT 檢測可靠性的前提,需嚴格遵循判定標準,且需結合實驗室實際條件驗證適配的標準閾值。質控樣品的判定規則明確:NTC(無模板對照)的 FAM 信號需 2 復孔 Ct≥40 或無明顯擴增曲線,VIC 信號需 2 復孔 Ct<35 且呈有效 “S” 型擴增;NCS(陰性對照)判定標準與 NTC 一致;PC(陽性質控)的 FAM 信號需 2 復孔 Ct<35 且呈有效 “S” 型擴增,PCS(陽性對照底物)判定標準與 PC 一致。只有質控結果全部滿足要求,才能進一步分析樣本結果,若質控不達標,需排查設備、試劑、操作等環節的問題并重新檢測。 病毒收獲液、抗體 UPB 等中間產物...
2025-12-02 -
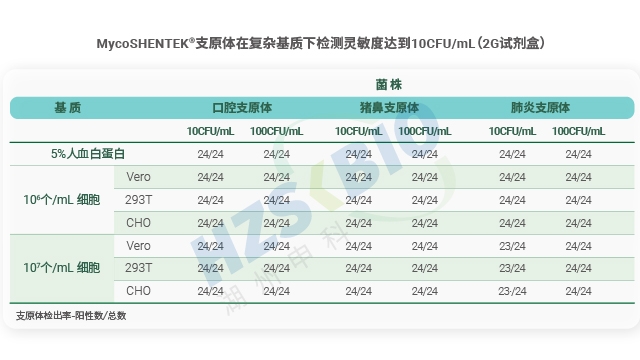 廣東免疫細胞產品支原體檢測NAT法
廣東免疫細胞產品支原體檢測NAT法對照菌株的合理配置是支原體培養法檢測準確性的重要保障,湖州申科嚴格遵循 USP 標準制定菌株使用規范。每次檢測需至少包含兩株已知支原體菌株:一株為葡萄糖發酵型(如肺炎支原體或其等效種株),另一株為精氨酸水解型(如口腔支原體),通過兩類菌株的平行對照,覆蓋常見支原體檢測場景。特殊場景下需額外補充菌株:檢測昆蟲細胞系時,需納入螺原體(如 S.citri ATCC 29747、S.melliferum ATCC 29416 或等效菌種菌株),這類菌株營養需求更苛刻,且需匹配昆蟲細胞系對應的較低孵化溫度,確保特殊樣品檢測的針對性與有效性,避免因菌株配置不全導致漏檢風險。 支原體標準菌株對支原體檢測...
2025-12-02 -
 廣東細胞療法產品支原體檢測可比性驗證
廣東細胞療法產品支原體檢測可比性驗證針對不同類型的樣品基質,需采用定制化的支原體檢測前處理方案,以消除干擾、提升檢測效果。細胞懸液需經熱處理、樣品處理液作用、細胞碎片去除、濃縮離心,再 55℃消化;上清或高濃度質粒樣品需先濃縮離心,再用樣品處理液作用后 55℃消化;5% 人血白蛋白樣品則采用濃縮離心 + 樣品處理液作用 + 25℃消化的流程。常見干擾基質包括凍存保護劑、高濃度細胞、代謝產物等,優化前處理可遵循三大原則:提取前通過離心取上清或去除抑制劑預處理樣品;高濃度蛋白樣本提取時增加蛋白酶 K 用量,增強蛋白降解效果;細胞類樣品適當降低細胞數或先裂解細胞,減少細胞基質對檢測的干擾。 湖州申科支原體檢測快速版試劑盒 2-2....
2025-11-20 -
 河南生物制品支原體檢測培養法
河南生物制品支原體檢測培養法質控結果是支原體 NAT 檢測可靠性的前提,需嚴格遵循判定標準,且需結合實驗室實際條件驗證適配的標準閾值。質控樣品的判定規則明確:NTC(無模板對照)的 FAM 信號需 2 復孔 Ct≥40 或無明顯擴增曲線,VIC 信號需 2 復孔 Ct<35 且呈有效 “S” 型擴增;NCS(陰性對照)判定標準與 NTC 一致;PC(陽性質控)的 FAM 信號需 2 復孔 Ct<35 且呈有效 “S” 型擴增,PCS(陽性對照底物)判定標準與 PC 一致。只有質控結果全部滿足要求,才能進一步分析樣本結果,若質控不達標,需排查設備、試劑、操作等環節的問題并重新檢測。 全血基質中100 CFU/mL支原體...
2025-11-20 -
 江西疫苗產品支原體檢測驗證菌株
江西疫苗產品支原體檢測驗證菌株湖州申科支原體檢測解決方案優勢突出,一是產品驗證專業:嚴格確認菌株 GC 比,可溯源至 ATCC/CVCC,專屬性驗證涵蓋多種梭菌、乳桿菌、鏈球菌,完全符合 EP 要求,而部分競品未明確菌株驗證標準或缺乏近緣菌交叉污染測試;二是菌株資源豐富:提供可溯源、可商用的驗證菌株,嚴格控制 GC 比,聯合合規機構共同標定;三是一站式解決方案:涵蓋 “產品 + 菌株 + 技術服務” 全鏈條,擁有上市藥物方法變更驗證服務案例,可提供全申報周期支持;四是申報案例豐富:積累了 BLA、IND 階段的多個成功案例,支持客戶完成國產替代與方法變更,競品申報案例相對有限,且部分企業規模較小,難以接受供應商審計,服...
2025-11-19 -
 福建復雜基質支原體檢測可比性驗證
福建復雜基質支原體檢測可比性驗證檢測限驗證是支原體 NAT 方法(核酸擴增法)合規性的關鍵要求,法規明確界定需為每種目標支原體確定陽性檢測臨界值。驗證流程需滿足嚴格的實驗設計:每種支原體至少進行三次單獨的 10 倍梯度稀釋,每次稀釋后需制備平行管檢測,再確保各稀釋濃度獲得 24 個檢測結果。陽性臨界值的判定標準為,該濃度下至少 95% 的試驗運行能得到陽性結果,即 24 個樣品中需至少出現 23 個有效陽性結果。這一嚴謹設計旨在確保 NAT 檢測方法在實際應用中,能夠穩定檢出低濃度支原體污染,避免因檢測靈敏度不足導致的安全風險,為生物制品質量控制提供可靠保障。 復雜樣品在進行支原體檢測時,可適當稀釋樣本或增加蛋白酶 K ...
2025-11-19 -
 安徽重組藥物支原體檢測快速檢測
安徽重組藥物支原體檢測快速檢測湖州申科圍繞 USP 支原體培養法,提供技術服務,滿足生物制劑企業的合規需求。服務內容包括兩項:一是支原體培養法樣品檢測服務,嚴格遵循 USP 63 標準流程執行,確保檢測結果合規有效;二是支原體培養法樣品適用性驗證服務,針對供試品特性開展定制化驗證,保障檢測方法與樣品的適配性。所有檢測與驗證完成后,公司將出具標準化報告,報告可直接用于項目申報、審批、工藝優化等場景,為企業產品質量控制提供依據。通過專業的技術服務,幫助企業規避合規風險,確保生物制劑生產全流程的質量與安全性,助力企業高效推進產品研發與上市進程。 CAR-T 產品支原體檢測需在放行前快速完成,湖州申科快速版試劑盒 2.5 小時...
2025-11-19 -
 湖北干細胞產品支原體檢測NAT法
湖北干細胞產品支原體檢測NAT法湖州申科構建了覆蓋全領域、全場景的支原體檢測一站式合規解決方案。產品矩陣豐富,包括支原體 DNA 提取純化試劑盒(2G)、檢測試劑盒(2G,PCR - 熒光探針法)、DNA 校準品、一體化檢測卡盒、外源因子全自動核酸分析系統,以及 10 余種支原體驗證菌株(已上市豬鼻、肺炎、口腔支原體等,即將上市發酵、精氨酸支原體等)。方案具備極強的場景適配性,可應對 5% 人白、高濃度細胞等復雜基質樣品,支持從起始材料到終產品的全流程檢測,滿足細胞療法、抗體、疫苗、CRO/CDMO 等不同領域的檢測需求。服務層面,提供從方法學建立、樣品檢測、適用性驗證、傳統法與 qPCR 法比對到特殊菌株定制的全流程技...
2025-11-19 -
 安徽生物制品支原體檢測國產替代
安徽生物制品支原體檢測國產替代支原體 NAT 檢測中常見三類問題,其成因多與樣品基質、操作規范或污染防控相關。1、樣品基質干擾,高濃度 DMSO、人血白蛋白等凍存保護劑,高濃度細胞、DNA 碎片等復雜成分,會抑制檢測反應或干擾信號讀取。2、檢測曲線異常,表現為非特異性擴增圖譜,多因引物設計不當、反應條件優化不足或試劑交叉污染導致。3、陰性污染,具體體現為無模板對照(NTC)、陰性對照(NCS)出現翹尾現象,主要源于實驗室分區不合理、操作流程不規范(如陰陽性樣本交叉處理)、耗材污染或環境氣溶膠污染,這些問題均會影響結果判定的準確性,需針對性解決。 歐洲藥典(EP)2.6.7 認可 NAT 法作為支原體檢測替代方法,需通過...
2025-11-19 -
 福建細胞療法產品支原體檢測可比性驗證
福建細胞療法產品支原體檢測可比性驗證檢測限驗證是支原體 NAT 方法(核酸擴增法)合規性的關鍵要求,法規明確界定需為每種目標支原體確定陽性檢測臨界值。驗證流程需滿足嚴格的實驗設計:每種支原體至少進行三次單獨的 10 倍梯度稀釋,每次稀釋后需制備平行管檢測,再確保各稀釋濃度獲得 24 個檢測結果。陽性臨界值的判定標準為,該濃度下至少 95% 的試驗運行能得到陽性結果,即 24 個樣品中需至少出現 23 個有效陽性結果。這一嚴謹設計旨在確保 NAT 檢測方法在實際應用中,能夠穩定檢出低濃度支原體污染,避免因檢測靈敏度不足導致的安全風險,為生物制品質量控制提供可靠保障。 支原體污染會改變細胞生理特性,導致生長緩慢、基因表達異常,需...
2025-11-19 -
 河北干細胞產品支原體檢測驗證菌株
河北干細胞產品支原體檢測驗證菌株陰性翹尾是支原體 NAT 檢測中常見的異常現象,表現為 NCS 或 NTC 出現擴增信號,Ct 值多在 35~40 之間,需科學評估并處理。首先考慮污染因素,可能是陰性對照被陽性樣本、試劑或環境氣溶膠污染,建議立即復測,復測時使用帶濾芯低吸附 TIP 頭,嚴格執行陰陽性分區操作,注重細節防控。其次需排除背景信號等非典型性擴增的干擾,避免誤判為污染。若前期驗證中頻繁出現 NTC 或 NCS 擴增,且已徹底排除污染可能性,可結合已有實驗數據重新設置 Cut off 值,確保閾值線能有效區分真實陽性與背景信號,滿足實驗室檢測需求。 支原體檢測 NAT 法引物設計需平衡覆蓋范圍與特異性,避免交叉反...
2025-11-19 -
 吉林重組藥物支原體檢測可比性驗證
吉林重組藥物支原體檢測可比性驗證湖州申科構建了具有完備資質的支原體技術服務平臺,為企業提供多元化支持。平臺擁有 BSL-2/P2 微生物實驗室備案資質,遵循 GMP-like 質量體系,具備支原體培養法、指示細胞法與 qPCR 法的檢測及驗證能力,配備符合藥典要求的支原體標準菌株庫與高靈敏度培養基(含液體、固體、半流體)。企業已通過 ISO13485:2016 質量管理體系認證(證書號 MD 709873),檢測中心獲得 CNAS 認證(注冊號 CNAS L21942),符合 ISO/IEC 17025:2017 標準,具備國際互認資質。平臺可提供多元化技術服務,包括支原體 qPCR 法檢測能力建立、實驗員能力考核、質量...
2025-11-19 -
 重組藥物支原體檢測
重組藥物支原體檢測外源因子全自動核酸檢測分析系統系統在數據追溯與合規管理方面進行了針對性設計,完美適配生物藥行業的嚴格監管要求。系統內置三級權限管理機制,可對操作人員、檢測項目、數據訪問進行準確管控,同時具備完善的日志審計追蹤功能,詳細記錄檢測全流程的關鍵信息,確保數據可追溯、可核查,完全符合 21CFR Part11 法規要求。數據傳輸方面,系統支持與 LIMS 實驗室信息管理系統無縫對接,實現檢測數據的自動同步與集中管理,同時配備 USB 接口,可直接連接打印機打印實驗結果,滿足企業紙質記錄存檔需求。這些功能讓支原體檢測的每一個環節都處于合規管控之下,為企業應對監管檢查、保障數據真實性提供了有力支持。 ...
2025-11-18 -
 天津干細胞產品支原體檢測快速檢測
天津干細胞產品支原體檢測快速檢測取樣量的科學設計直接影響支原體檢測的代表性與靈敏度,需結合樣品總體積、基質特性綜合考量。法規建議:產品總體積大于1000mL的按無菌檢查法取樣,10-1000mL 取總體積的 1%,1-10mL 取 100μL,小于1mL的需采用替代取樣方案。實際檢測中,取樣體積越大,靈敏度越高,但需平衡洗脫液消耗與重復檢測需求。此外,支原體兼具胞內胞外生存特性,只檢測上清會導致漏檢,需采用細胞裂解等處理方式,確保覆蓋全部污染靶點,提升檢測結果的真實性。 支原體檢測過程中,需嚴格遵循 “先陰后陽” 操作原則,避免交叉污染。天津干細胞產品支原體檢測快速檢測 此前,支原體檢測依賴培養法和指示細胞培養法,這兩...
2025-11-18 -
 江西復雜基質支原體檢測快速檢測
江西復雜基質支原體檢測快速檢測細胞和基因治療領域正加速發展,國內以 CAR-T、間充質干細胞、AAV 基因治療等新型生物制品勢頭正盛。這類產品與傳統制藥差異明顯,給支原體檢測帶來全新挑戰:批產量小但批次多,多數待檢測樣品含高達 10?個活細胞,且基質復雜如高蛋白、全血、高濃度質粒等。更關鍵的是,新型生物制品終末滅菌難度極大,需從起始材料、原物料到全工藝過程嚴格控污,而支原體污染隱蔽性強、危害大,成為質量安全控制的主要痛點,也推動著檢測方法向更高效、抗干擾的方向升級。 支原體檢測是生物制品質量控制的關鍵環節,需兼顧合規性與檢測效率。江西復雜基質支原體檢測快速檢測 支原體 NAT 檢測的樣本結果需結合 FAM 信號與 V...
2025-11-18 -
 四川生物制品支原體檢測快速檢測
四川生物制品支原體檢測快速檢測湖州申科的支原體檢測方案已在多個領域積累了豐富的客戶申報案例,覆蓋細胞療法、抗體藥物、疫苗、CRO/CDMO 等細分賽道。在細胞療法領域,方案成功應用于已上市藥物的方法變更,替換進口試劑盒并通過中檢院復核,驗證結果獲得 CDE 認可用于產品放行檢測在抗體藥物領域,支持多家企業完成 BLA 申報;在疫苗與 CRO/CDMO 領域,為諸多頭部企業提供 IND 申報支持。方案的應用場景涵蓋從 IND 到 BLA/NDA 的全申報周期,適配自動化提取 + 檢測試劑盒 + 菌株 + qPCR 儀、外源因子一體機等多種配置,滿足不同企業的個性化檢測需求,獲得市場認可。 歐洲藥典2.6.7 要求測定支原...
2025-11-18 -
 湖南細胞療法產品支原體檢測指示細胞培養法
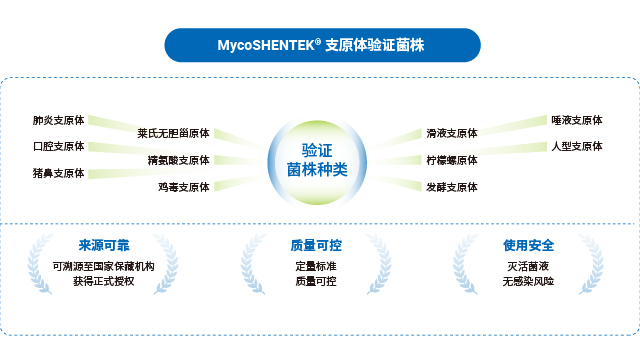
湖南細胞療法產品支原體檢測指示細胞培養法湖州申科的支原體驗證菌株是支原體檢測 NAT 方法驗證的可靠選擇,具備多重質量保障。菌株來源可靠,均取自國內外認可的合規機構驗證菌株標準盤,溯源至美國模式菌種收集中心(ATCC)、中國獸醫微生物菌種保藏管理中心(CVCC)等正規保藏機構,獲得正式授權商用,如口腔支原體、肺炎支原體溯源至 ATCC,豬鼻支原體溯源至 CVCC。菌株生產在 BSL-2 生物安全實驗室開展,符合國家生物安全法標準,針對不同菌株特性逐個優化生產工藝,涵蓋超 10 種菌株的主代與工作代。質控環節嚴謹,采用固體平皿培養法測定 CFU(菌落形成單位),凍存前后均進行檢測,確保菌落易觀察分離與計數準確性;同時聯合官方機構建...
2025-11-18 -
 安徽生物制品支原體檢測NAT法
安徽生物制品支原體檢測NAT法檢測限驗證是支原體 NAT 方法(核酸擴增法)合規性的關鍵要求,法規明確界定需為每種目標支原體確定陽性檢測臨界值。驗證流程需滿足嚴格的實驗設計:每種支原體至少進行三次單獨的 10 倍梯度稀釋,每次稀釋后需制備平行管檢測,再確保各稀釋濃度獲得 24 個檢測結果。陽性臨界值的判定標準為,該濃度下至少 95% 的試驗運行能得到陽性結果,即 24 個樣品中需至少出現 23 個有效陽性結果。這一嚴謹設計旨在確保 NAT 檢測方法在實際應用中,能夠穩定檢出低濃度支原體污染,避免因檢測靈敏度不足導致的安全風險,為生物制品質量控制提供可靠保障。 EP 新規明確支原體驗證菌株 GC/CFU 比值<10,需在...
2025-11-17 -
 江蘇重組藥物支原體檢測驗證菌株
江蘇重組藥物支原體檢測驗證菌株全球主流藥典對支原體 NAT 檢測的標準菌株選擇形成了明確共識,中國、歐洲、美國、日本四國藥典一致推薦優先使用豬鼻支原體、口腔支原體、肺炎支原體三種菌株,用于 NAT 方法檢測限的驗證,這一選擇基于支原體的污染發生頻率與進化關系。不同地區法規的驗證范圍略有差異:EP、USP、ChP 要求覆蓋特異性、檢測限、耐受性,WHO 還需包含半定量與定性實驗;部分地區如歐洲藥典額外納入萊氏無膽甾原體、滑液支原體等菌株,針對昆蟲和植物來源物料生產場景則需關注螺原體等特殊菌株。合規的標準菌株是 NAT 檢測方法驗證的前提,其溯源性與授權資質直接影響檢測結果的認可度。 rHCDpurify 前處理系統可自動...
2025-11-17 -
 重慶疫苗產品支原體檢測核酸擴增法
重慶疫苗產品支原體檢測核酸擴增法湖州申科圍繞 USP 支原體培養法,提供技術服務,滿足生物制劑企業的合規需求。服務內容包括兩項:一是支原體培養法樣品檢測服務,嚴格遵循 USP 63 標準流程執行,確保檢測結果合規有效;二是支原體培養法樣品適用性驗證服務,針對供試品特性開展定制化驗證,保障檢測方法與樣品的適配性。所有檢測與驗證完成后,公司將出具標準化報告,報告可直接用于項目申報、審批、工藝優化等場景,為企業產品質量控制提供依據。通過專業的技術服務,幫助企業規避合規風險,確保生物制劑生產全流程的質量與安全性,助力企業高效推進產品研發與上市進程。 全血基質中100 CFU/mL支原體,湖州申科支原體檢測試劑盒通過優化提取流程實...
2025-11-17 -
 陜西干細胞產品支原體檢測國產替代
陜西干細胞產品支原體檢測國產替代MycoSHENTEK? 支原體 qPCR 檢測試劑盒(2G)完全符合 EP 2.6.7 的全部驗證要求,其檢測靈敏度、特異性、耐用性均按藥典標準完成完整性能驗證,具備替代培養法和指示細胞培養法的合規資質。該試劑盒針對新型生物制品的檢測痛點優化升級,經多種支原體菌株驗證,靈敏度穩定達到 10 CFU/mL,滿足法規對替代培養法的要求。同時,產品遵循 ISO13485 體系認證和 GMP-like 生產標準,可提供完整的驗證報告、質檢報告及菌株溯源文件,全程貼合各國藥典監管要求,為企業合規檢測提供堅實支撐。 支原體檢測可比性驗證要求 NAT 法與傳統方法同步檢測,確保 LOD 指標等效。陜西...
2025-11-17 -
 山東疫苗產品支原體檢測技術服務
山東疫苗產品支原體檢測技術服務MycoSHENTEK? 支原體 qPCR 檢測試劑盒(2G)完全符合 EP 2.6.7 的全部驗證要求,其檢測靈敏度、特異性、耐用性均按藥典標準完成完整性能驗證,具備替代培養法和指示細胞培養法的合規資質。該試劑盒針對新型生物制品的檢測痛點優化升級,經多種支原體菌株驗證,靈敏度穩定達到 10 CFU/mL,滿足法規對替代培養法的要求。同時,產品遵循 ISO13485 體系認證和 GMP-like 生產標準,可提供完整的驗證報告、質檢報告及菌株溯源文件,全程貼合各國藥典監管要求,為企業合規檢測提供堅實支撐。 支原體檢測NAT法(核酸擴增法)周期只需 3-6 小時,靈敏度高、特異性強,是生物制...
2025-11-17 -
 江蘇干細胞產品支原體檢測技術服務
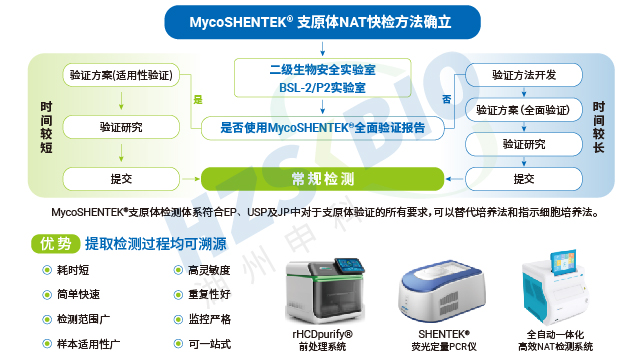
江蘇干細胞產品支原體檢測技術服務為解決傳統方法的局限,各國藥典紛紛認可支原體核酸檢測(NAT)法作為替代方案。EP 2.6.7、USP <77>、JP
均明確了 NAT 法的應用標準,《中國藥典》3301 也規定 “可采用經國家藥品檢定機構認可的其他方法”,并明確 NAT 法替代培養法時檢測限需達 10 CFU/mL,替代指示細胞培養法時需達 100 CFU/mL。NAT 法憑借檢測速度快、特異性強的優勢,成為新型生物制品支原體檢測的理想選擇,且法規明確只要通過相關驗證,即可正式替代傳統方法,為企業提供了合規且高效的檢測路徑。 支原體標準菌株對支原體檢測試劑盒的選擇、使用及驗證至關重要。江蘇干細胞產... 2025-11-17 -
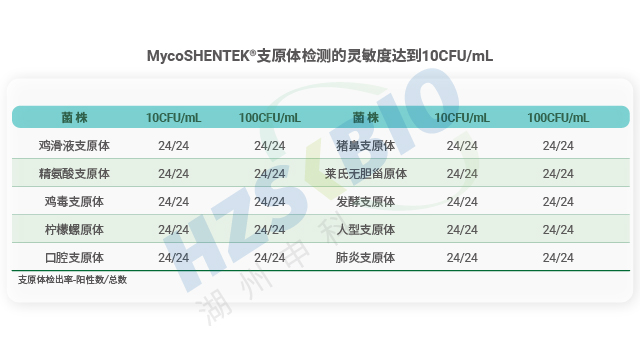 江西干細胞產品支原體檢測使用性驗證
江西干細胞產品支原體檢測使用性驗證湖州申科外源因子全自動核酸檢測分析系統打造了 “樣本進、結果出” 的高效檢測流程,徹底簡化支原體檢測操作。檢測只需一步式加樣,最大支持 1mL 樣本直接上樣,無需復雜前處理,加樣后系統自動完成核酸提取與檢測,全程 3 小時內即可獲取結果,其中樣本準備時間不足 5 分鐘,檢測流程只需 2.5 小時。相比傳統方法水浴消化、磁珠分離、洗脫等繁瑣步驟,該系統操作極大簡化,且配備 UI 觸屏控制系統,內置標準化程序,支持掃碼啟動檢測,無需專業 qPCR 操作培訓,普通人員經簡單指導即可上手。系統采用 4 通道單獨運行設計,可同步開展不同樣本檢測,儀器還支持疊加延展通道,進一步提升檢測產能,適配生物藥...
2025-11-17 -
 天津細胞療法產品支原體檢測驗證菌株
天津細胞療法產品支原體檢測驗證菌株湖州申科的支原體培養法樣品檢測流程嚴格遵循 USP 標準,步驟規范且邏輯嚴謹。接種環節:每 100mL 液體培養基接種 10mL 供試品,每類固體培養基接種 0.2mL 供試品;培養條件:置于 36±1℃、5-10% CO?的濕潤環境中培養 28 天。繼代培養需在特定時間點開展:接種后第 2-4 天、第 6-8 天、第 13-15 天、第 19-21 天,每次從每種液體培養基中吸取至少 0.2mL,接種至對應固體培養基繼續培養不少于 14 天,其中第 20-21 天的繼代培養需持續 7 天。觀察頻率為每 2-3 天一次,若液體培養物出現顏色變化,需立即進行繼代培養,再通過與陰陽性對照培養基...
2025-11-17 -
 河北疫苗產品支原體檢測核酸擴增法
河北疫苗產品支原體檢測核酸擴增法針對不同類型的樣品基質,需采用定制化的支原體檢測前處理方案,以消除干擾、提升檢測效果。細胞懸液需經熱處理、樣品處理液作用、細胞碎片去除、濃縮離心,再 55℃消化;上清或高濃度質粒樣品需先濃縮離心,再用樣品處理液作用后 55℃消化;5% 人血白蛋白樣品則采用濃縮離心 + 樣品處理液作用 + 25℃消化的流程。常見干擾基質包括凍存保護劑、高濃度細胞、代謝產物等,優化前處理可遵循三大原則:提取前通過離心取上清或去除抑制劑預處理樣品;高濃度蛋白樣本提取時增加蛋白酶 K 用量,增強蛋白降解效果;細胞類樣品適當降低細胞數或先裂解細胞,減少細胞基質對檢測的干擾。 生物制品企業需建立支原體檢測質量體系,滿...
2025-11-17